如何通过读文献提升科研思维和课题设计能力?实战篇【做科研的大师兄】
上一帖分享了如何通过读文献提升科研思维和课题设计能力?原则篇
本帖将结合文献精读实例,为大家展示如何精读解析一篇主刊文献,并从中提取科研思维和课题设计的借鉴之处!【建议重点读文末的研究思路解读】
此次精读案例是发表在Nature上的一篇研究论文,精读内容如下:
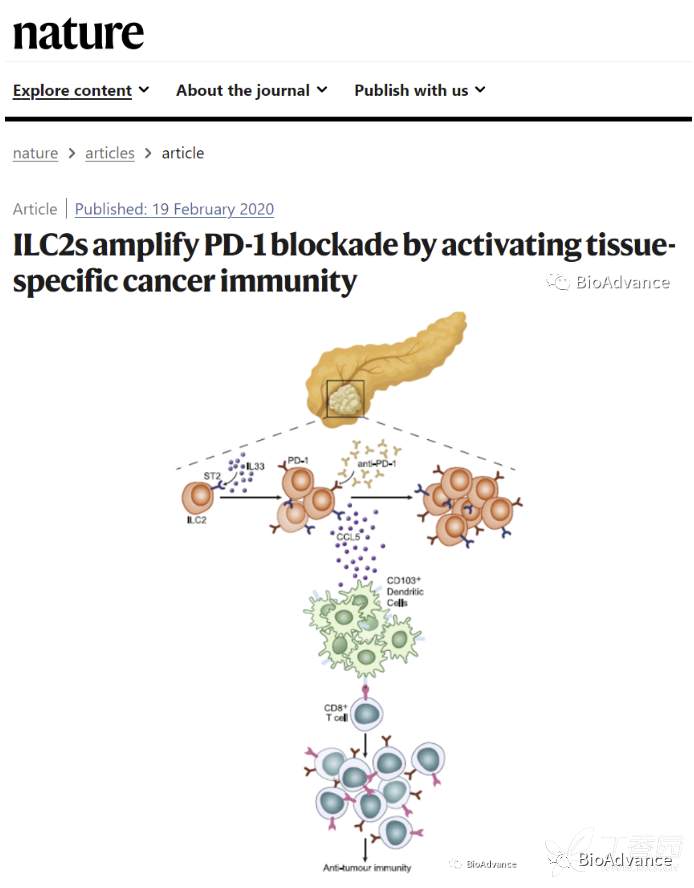
题目:
ILC2s通过激活组织特异性肿瘤免疫增强PD-1阻断治疗效果
研究背景:
已有文献表明:ILC2s作为一种天然淋巴细胞,参与调控组织炎症和免疫且ILC2s已发现存在于多种肿瘤组织中。然而ILC2s在肿瘤免疫及免疫治疗中的作用尚未阐明。
ILC2s激活
多种细胞因子(IL-25、IL-33、TSLP、TL1A等)可以作用于ILC2s表面受体,激活ILC2s,促进其扩增并释放2型免疫细胞因子IL-4、IL-5、IL-9、IL-13,参与免疫调控(如下图)。关于更多ILCs的背景知识,可以查阅之前文章一文详解天然淋巴细胞(ILCs)—肿瘤免疫研究新宠,快上车了解!
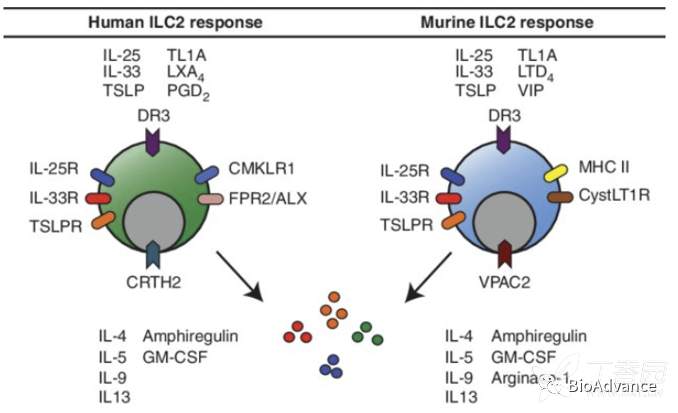
细胞因子激活ILC2
本研究要解决的科学问题是:
ILC2s在肿瘤免疫和免疫治疗中的具体作用是什么?
研究模型:
- 自发胰腺癌KPC小鼠模型;
- 胰腺癌原位瘤模型;
- IL33敲除小鼠模型;
- ILC2s条件性敲除小鼠模型;
- DC敲除小鼠模型;
- PD-1敲除小鼠模型;
- CD45.1和CD45.2小鼠。
研究结果:
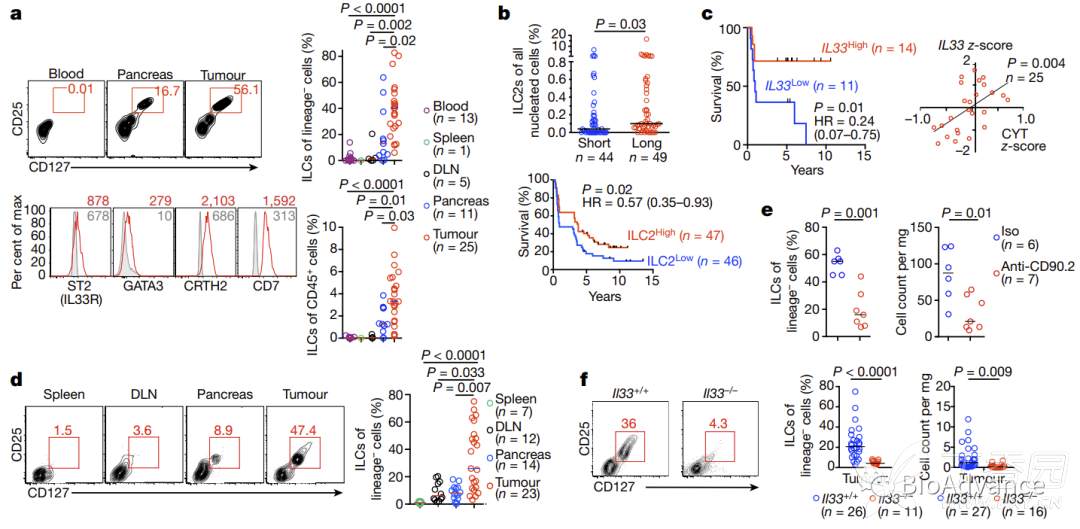
1.人和小鼠胰腺癌组织中存在IL33依赖的ILC2s浸润
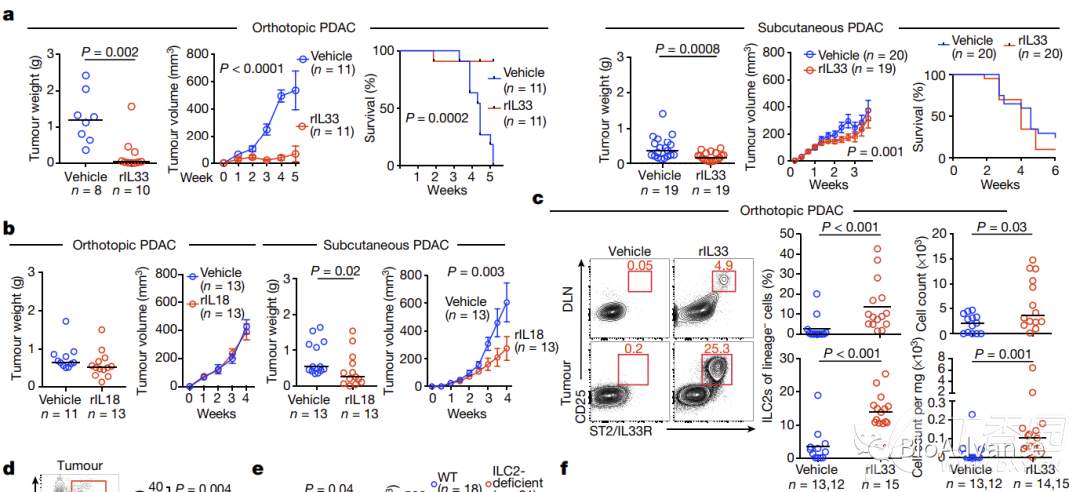
为了研究ILC2s在胰腺癌中的作用,作者首先比较了人胰腺癌患者外周血、胰腺正常组织和胰腺癌肿瘤组织中ILC2s浸润情况,发现在胰腺癌肿瘤组织中ILCs明显富集,且这群ILCs表现出显著的ILC2s表型(图a)。通过分析胰腺癌患者生存,发现生存时间越久,则ILC2s水平越高;且生存分析提示ILC2s水平越高,患者生存时间越久(图b),提示ILC2s很可能发挥抗肿瘤免疫作用。接着,作者对人胰腺癌组织进行了bulk RNA seq,比较分析了可以激活ILC2s的细胞因子IL33、IL25等表达水平在胰腺癌患者生存预后和抗肿瘤作用之间的相关性,发现其中只有IL33与预后显著相关,其表达水平越高,生存时间越久(图c左)。且IL33表达水平与抗肿瘤signature呈正相关(图c右),提示IL33很可能通过激活ILC2s发挥抗肿瘤作用。接着,为了从动物模型验证以上猜想,研究首先比较了小鼠自发胰腺癌模型和原位瘤模型中ILC2s的浸润情况,发现两种胰腺癌小鼠模型都能模拟人PDAC中ILC2s表型(ILC2s在肿瘤组织显著增加),表明ILC2s在胰腺癌人和小鼠中的保守性,这两种模型可以作为后续实验研究ILC2s在胰腺癌中作用的可靠模型!为了证明IL33通过激活ILC2s发挥作用,作者在IL33敲除小鼠模型构建胰腺癌原位瘤,流式检测肿瘤组织ILC2水平,结果表明IL-33敲除之后,小鼠肿瘤组织中ILC2水平显著下降。以上结果证实,胰腺癌组织中增多的ILC2具有IL33依赖性。
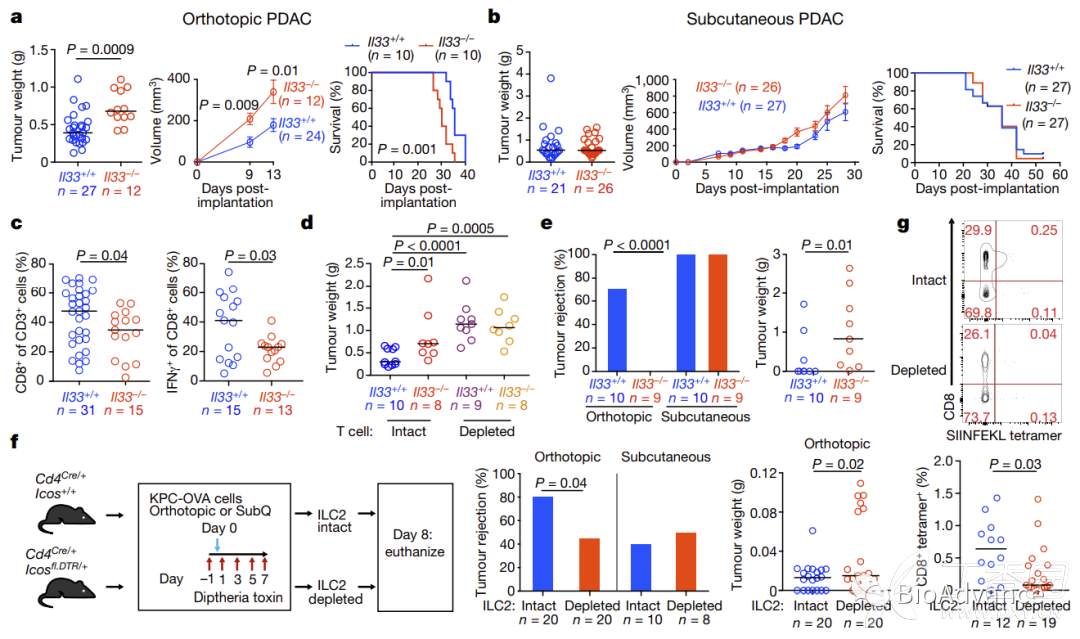
2.IL33-ILC2轴激活组织特异性的抗肿瘤免疫反应
已有文献报道,ILC2s具有组织特异性,为了探究在胰腺癌中ILC2作用是否也有组织特异性,本研究首先在IL33敲除小鼠(间接形成ILC2敲除模型)中,分别构建胰腺癌原位瘤(胰腺特定组织环境)和皮下瘤(肺胰腺组织环境)两种移植瘤模型。结果表明,IL33敲除(ILC2缺失)可以显著促进原位瘤模型的肿瘤恶性表型(肿瘤生长更快、小鼠预后更差)(图a)。相比之下,在皮下瘤模型中,IL33敲除(ILC2缺失)对肿瘤恶性表型基本无影响(图b),证实IL33敲除(ILC2缺失)的促癌作用具有组织特异性。接着,为了回答IL33-ILC2轴如何发挥抗肿瘤免疫作用的问题,本研究利用RNA-seq分析了IL33+/+ vs IL33-/- PDAC原位瘤肿瘤内CD45+细胞转录组,发现IL33敲除(ILC2缺失)时,MHCI抗原提呈基因集合T细胞介导免疫基因集显著下调(附图3),提示IL33-ILC2轴很可能通过影响CD8T细胞priming过程发挥抗肿瘤免疫作用。进一步流式分析表明,IL33敲除(ILC2缺失)胰腺原位瘤肿瘤组织中CD8T细胞明显减少,且细胞毒作用显著降低(图c)。为了证实以上猜想,本研究在IL33敲除基础上继续清除CD8T细胞,发现在CD8T细胞删除情况下,IL33敲除(ILC2缺失)的促癌作用消失,证明IL33-ILC2轴发挥作用完全依赖于CD8T细胞(图d)。接着,本研究利用肿瘤排斥率这一指标反映抗肿瘤免疫程度,进一步证实了IL33-ILC2轴的抗肿瘤免疫具有胰腺组织特异性(图e)。进一步的,本研究将ILC2删除后构建胰腺原位瘤和皮下瘤模型并检测肿瘤排斥率、肿瘤体积、CD8数量和肿瘤OVA抗原特异性CD8T细胞百分比(图f、g),结果也证实了IL33-ILC2轴的抗肿瘤免疫具有胰腺组织特异性。
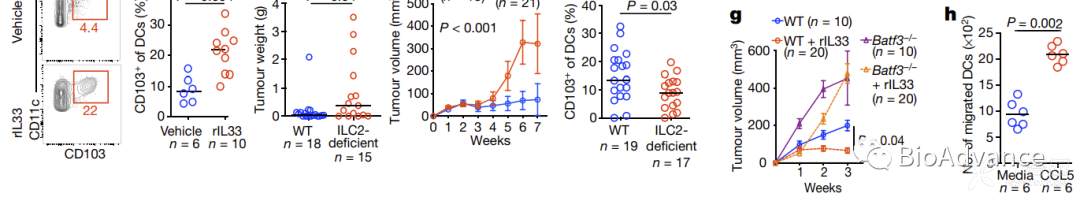
3.ILC2通过招募DC促进胰腺癌组织特异性抗肿瘤免疫
既然研究发现IL33可以激活ILC2发挥抗肿瘤作用,那么直接给予胰腺癌原位瘤模型小鼠重组rIL33是否也能发挥抗肿瘤作用呢?研究发现,通过直接给予rIL33可以发挥很好的抗肿瘤作用,而且具有胰腺组织特异性(图a,原位瘤有作用但皮下瘤无效果)。胰腺组织中ILC2表面特异性表达IL33R,为了证实rIL33通过ILC2表面IL33R使其特异性激活进而导致抗肿瘤免疫组织特异性,研究又利用皮下组织中ILC2特异表达IL18R这一特点,通过rIL18激活皮下瘤中ILC2,而不能激活胰腺组织中ILC2,通过原位瘤模型证实rIL18处理只对皮下瘤有作用,对于原位瘤无作用(图b)。以上结果证实IL33-ILC2轴组织特异性抗肿瘤免疫依赖于ILC2表面特异性细胞因子受体。接着流式分析证实,rIL33处理可以显著增加胰腺原位瘤肿瘤组织和浸润淋巴结中ILC2的扩增(图c)。既然第二部分结果已经证实IL33-ILC2轴发挥抗肿瘤作用依赖于CD8T细胞priming,那么ILC2是如何促进CD8T细胞激活的呢?众所周知,CD8T细胞激活依赖于树突状细胞DC,本研究自然而然首先检测了ILC2对DC的影响。结果发现rIL33处理(ILC2增加)可以显著促进肿瘤组织中DC浸润(图d)。而在ILC2条件性敲除小鼠中rIL33处理并不能引起DC浸润显著增加(图e),证实rIL33通过ILC2促进了DC浸润。那么ILC2如何促进DC浸润的?本研究利用了单细胞测序,分析发现肿瘤浸润的ILC2高表达趋化因子CCL5(附图8),而CCL5已报道可以趋化DC,通过体外趋化实验证实了CCL5对DC的趋化作用(图h)。同时,本研究利用DC敲除小鼠,证实IL33-ILC2发挥抗肿瘤作用依赖于DC(图g)。以上结果证实,ILC2通过招募DC促进胰腺癌组织特异性抗肿瘤免疫。
4.rIL33联合PD-1单抗方案增敏单独PD-1抗肿瘤免疫效果
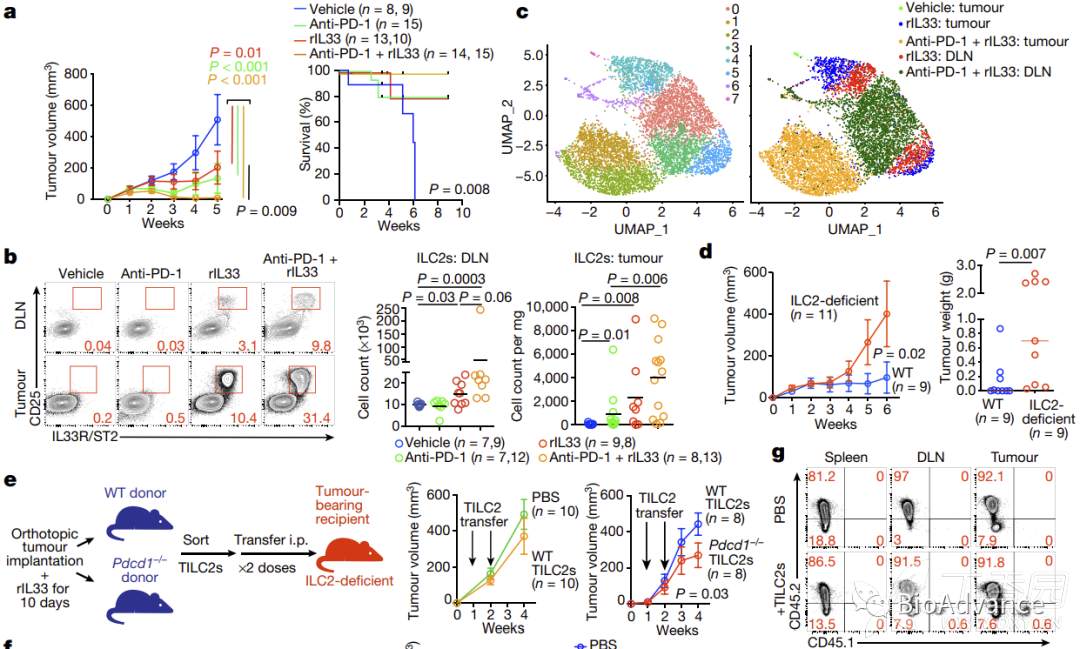
该研究中同时发现rIL33激活ILC2过程中,伴随着ILC2表面免疫抑制分子PD-1高表达(附图9),这提示可以利用rIL33联合PD-1单抗进一步释放ILC2的抗肿瘤免疫效能。为了证实这一猜想,本研究对胰腺癌原位瘤模型给予四种治疗方案(图a),发现rIL33联合PD-1单抗具有最佳的免疫治疗效果(图a)。流式分析结果表明rIL33联合PD-1单抗可以最大限度促进ILC2扩增(图b)。对这四种方案处理肿瘤组织中分选出来的ILC2进行单细胞测序,结果表明rIL33联合PD-1单抗处理组ILC2具有明显不同的转录特征(图c)。而在ILC2敲除小鼠中,rIL33联合PD-1单抗的方案效果明显被削弱(图d)。为了进一步证实这种rIL33联合PD-1单抗方案的有效性,本研究进一步纳入两种动物模型(图e,f),实验结果与预期一致,证明rIL33联合PD-1单抗方案可以显著增强单独PD-1单抗免疫治疗效果(图g-i)。
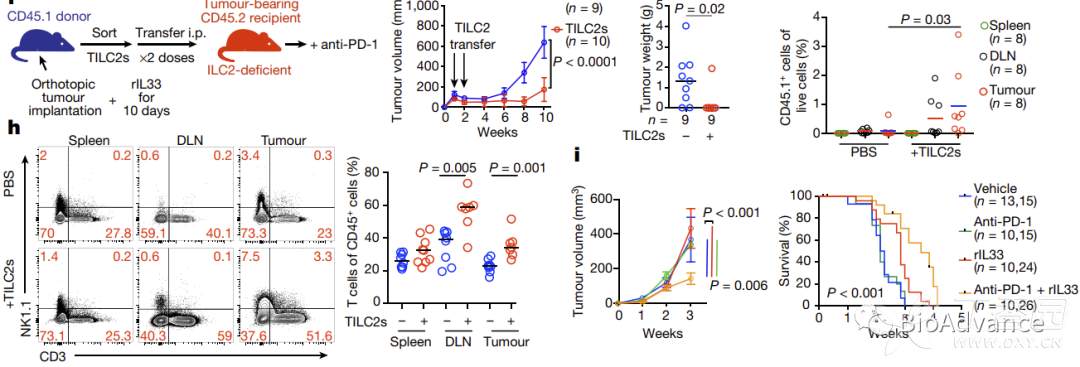
至此,本文证实了在胰腺癌组织中,IL33通过表面受体ILC33R激活ILC2,促进CCL5表达,招募DC到肿瘤微环境,进而priming CD8T并增强抗肿瘤免疫这一调控模式(IL33-ILC2-CCL5-DC-CD8T)。并基于研究发现开发出rIL33联合PD-1单抗有效治疗胰腺癌的方案!
研究思路解读
本研究集中关注ILC2在胰腺癌肿瘤免疫和免疫治疗中的作用,通过体内、体外实验证实ILC2如何发挥抗肿瘤作用以及ILC2如何在肿瘤中扩增这上下游两块内容。这种研究ILC2参与肿瘤免疫的逻辑,非常值得借鉴。本研究集中利用动物实验模型反复证实核心观点,对于机制细节很少利用体外实验展开(如ILC2如何分泌CCL5招募DC这一块机制研究尚不深入)。对于我们,在缺乏这么多敲除动物模型条件下,可以通过更多体外机制实验补充,在机制这一块做的更扎实也是一大亮点。
1. 为何选择ILC2作为研究切入点?
文中开头直接切入,指出ILC2s作为一种天然淋巴细胞,参与调控组织炎症和免疫且ILC2s已发现存在于多种肿瘤组织中。然而ILC2s在肿瘤免疫及免疫治疗中的作用尚未阐明,因此以ILC2作为切入点。仔细思量,这很可能并不是真实选择ILC2的原因。而且,本文并未展示任何关于ILC1和ILC3这两类亚群在胰腺癌中的水平以及作用,也没有用排除法证实ILC2在胰腺癌中的特殊性,比如含量最丰富等数据。推测直接选择ILC2作为切入点,定然另有原因,很可能该研究团队通过其具有的其它预实验数据或组学数据,提示ILC2在胰腺癌中的作用,或者ILC1和ILC3在胰腺癌中的作用该团队也在进行,出于保密故而没有展示相关数据。
2. 调控模式如何设计?
本研究提出的IL33-ILC2-CCL5-DC-CD8T这一调控模式是如何设计的?首先,以ILC2为研究焦点,向下游探究ILC2可以增强抗肿瘤免疫,RNA-seq组学数据提示ILC2很可能通过priming CD8T细胞发挥抗肿瘤免疫作用,而CD8T细胞priming最重要的是DC介导,因此只需找到ILC2是否可以招募DC,而DC的招募需要趋化因子(包括CCL5),作者通过分析ILC2组学数据,发现高表达CCL5,因此下游逻辑就可以串联起来,即ILC2-CCL5-DC-CD8T。接着考虑上游,ILC2是如何在肿瘤组织增加的。免疫细胞在组织增加有两种方式:被趋化因子招募而来或者在组织内扩增。考虑到ILC2大多是定居在组织中,所以优先想到ILC2是局部扩增增加导致数量增多。那么ILC2如何实现在肿瘤组织中局部扩增呢?基于之前文献报道细胞因子IL25、IL33等可以促进ILC2扩增,因而本研究比较分析了可以促进ILC2扩增的细胞因子水平,发现IL33在胰腺癌组织中水平最高,而且与胰腺癌患者预后显著相关,且与抗肿瘤免疫评分正相关,加之胰腺组织中ILC2表面特异表达IL33R,因此上游也完成了逻辑连接,即IL33-IL33R-ILC2。上下游逻辑实现打通串联之后,整个文章的调控模式就构建出来了,剩下的就是通过体内、体外实验数据支持这一调控模式!
















































