铁代谢指标:缺铁性贫血与慢性病性贫血鉴别诊断
 佛度有缘人 +3丁当
佛度有缘人 +3丁当铁的代谢
转运铁:转铁蛋白(Tf)是由肝细胞及单核-巨噬细胞合成的β1球蛋白,分子量约为75000-80000kD,678个氨基酸序列已被阐明,基因位于3号染色体。每个转铁蛋白可结合2个铁原子(Fe3+),将铁输送到全身各组织,将暂不用的铁送到贮存铁处,每天24小时至少转运约8-10次。正常情况下,仅1/3转铁蛋白的铁结合点被占据。血浆中所有转铁蛋白结合点构成血浆总铁结合力(TIBC)。
贮存铁:1. 铁蛋白为水溶性的氢氧化铁磷酸化合物与去铁蛋白结合而成,内部可容纳2000个铁原子,最大饱和时重量约为800kD。去铁蛋白单体分重(H)型和轻(L)型两种,H型单体摄取铁较L型快,但保留较少,肝脾内的去铁蛋白主要由L型单体组成。目前,人类铁蛋白的H型单体和L型单体的氨基酸序列均已被确定,其染色体位置分别在11号染色体及19号染色体上,铁蛋白的基因位置亦已阐明。2. 含铁血黄素是变性式聚合的铁蛋白,亦为水溶性,含铁量占其重量的25-30%,主要存在于单核-巨噬细胞中,显微镜下呈金黄色折光的颗粒或团块,若大量堆积于体内其他组织内,会损伤各组织器官功能。
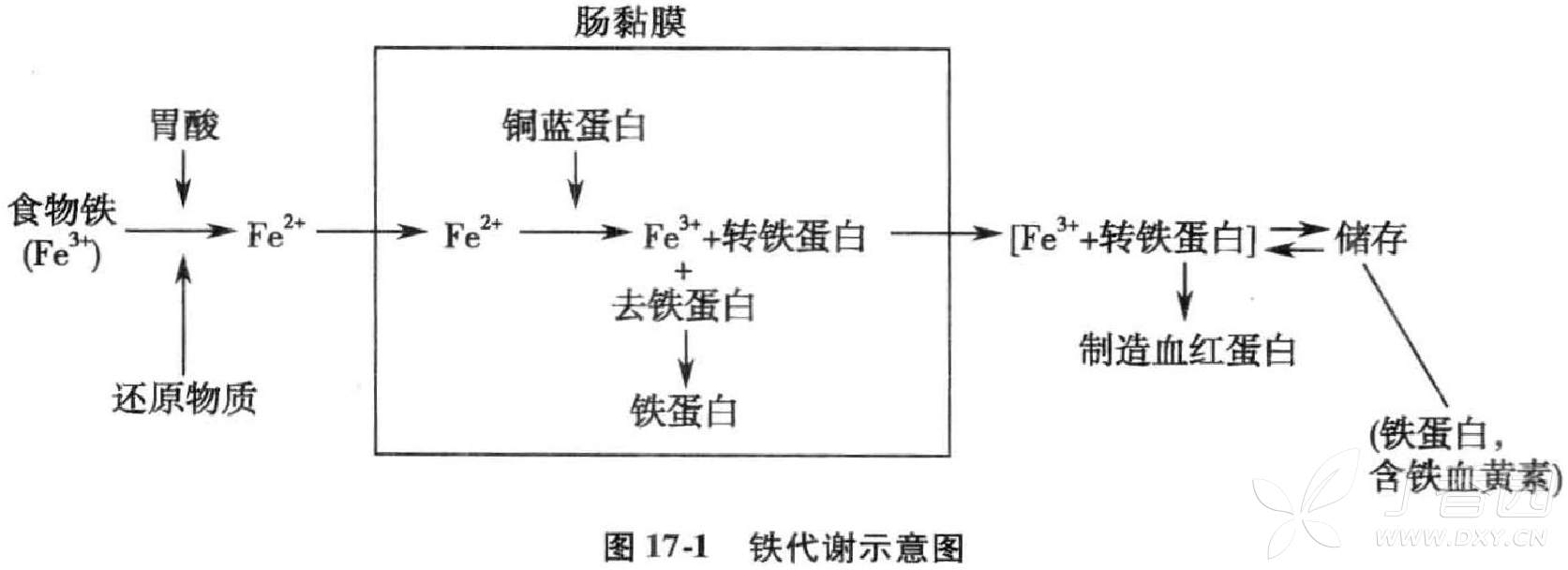
铁代谢:正常情况下,成年人每天从食物中摄取1-2mg铁(食物铁的含量应为10-20mg)。铁的吸收部位主要在十二指肠和空肠上段的黏膜。铁经肠黏膜上皮的吸收是主动的细胞内运转。但当口服大量铁剂时,铁亦可被动地弥散进入肠黏膜而发生急性铁中毒。极少量的肌红蛋白铁或血红素铁可被直接吸收。大部分的血红蛋白须先经血红素加氧酶分解成铁及四吡咯后才被吸收。非血红素铁以二价的铁离子(Fe2+)形式或与铁螯合物结合而被吸收。
食物进入肠道后,肠道黏膜细胞内的转铁蛋白分泌至肠腔内与食物中的铁结合。铁与转铁蛋白结合后,再与肠黏膜微绒毛上的受体结合而进入肠黏膜细胞。在黏膜细胞内,Fe2+被铜蓝蛋白及其他亚铁氧化酶氧化为Fe3+后与细胞内的转铁蛋白结合,越过细胞膜进入毛细血管网,剩余部分铁与细胞内的去铁蛋白结合形成铁蛋白存留于细胞中,3-5天后随肠黏膜细胞的更新脱落而排出体外。
进入血浆中的铁,与转铁蛋白结合后被带到骨髓及其他组织中去。每个转铁蛋白有两个结合铁的位点,可结合1个或2个铁离子(Fe3+)。带高铁的转铁蛋白在幼红细胞表面与转铁蛋白受体(TfR)结合,通过胞饮作用进入细胞内。在pH条件改变成酸性(pH=5)时,再度还原成Fe2+,与转铁蛋白分离。Fe2+在线粒体上与原卟啉、珠蛋白合成血红蛋白,多余的铁以铁蛋白形式存于细胞内,可用亚铁氰化钾染成蓝色,这类幼红细胞称为铁粒幼细胞。与铁分离后的转铁蛋白及转铁蛋白受体接着被排出细胞外,转铁蛋白回到血浆后可再度行使转运铁的功能。
鉴别诊断
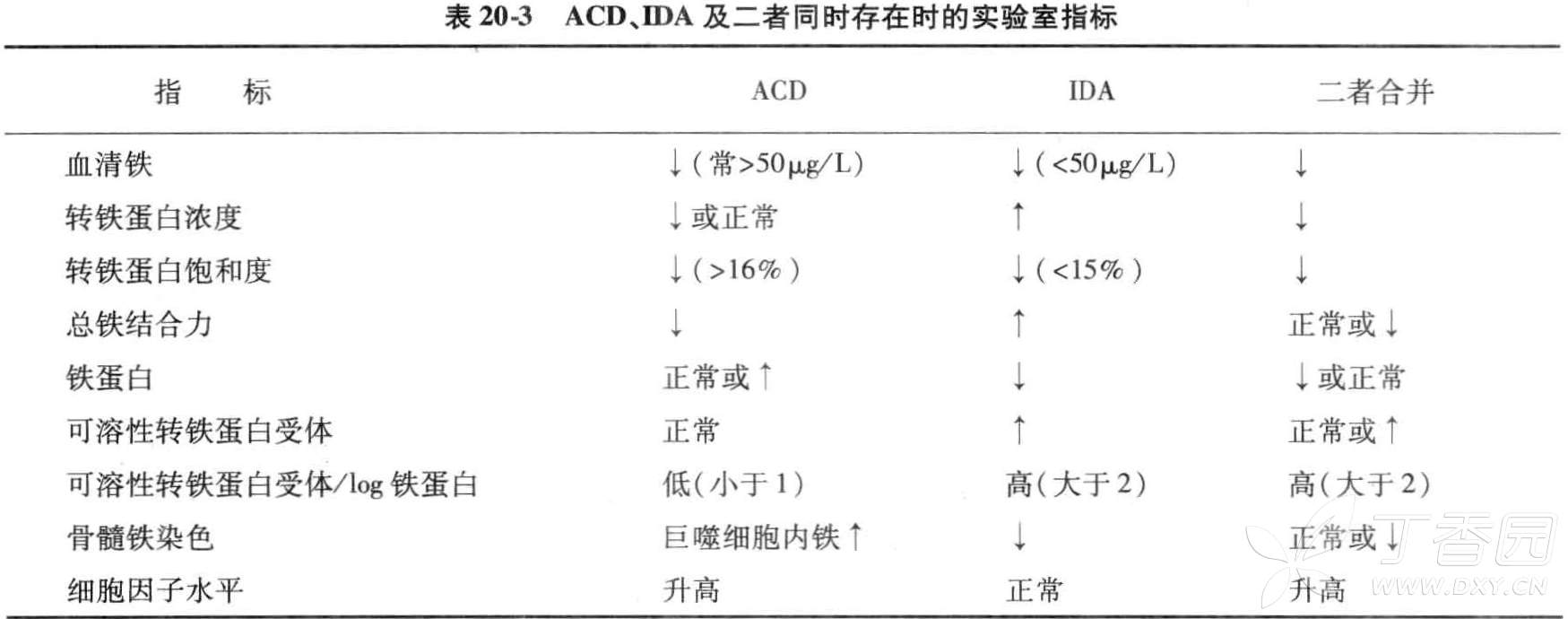
缺铁性贫血の铁代谢:血清铁降低[<8.95umol/L(50ug/dl)],总铁结合力增高[>64.44umol/L(360ug/dl)],故转铁蛋白饱和度降低。由于血清铁的测定波动大,影响因素较多,在判断结果时,应结合临床。在妇女月经前2-3天、妊娠的后3个月,血清铁和总铁结合力均会降低,但不一定表示缺铁。血清铁蛋白降低(14ug/L),但在伴有炎症、肿瘤及感染时可以增高,应结合临床或骨髓铁染色加以判断。缺铁性贫血患者骨髓红系细胞内及细胞外铁染色均减少或缺如。
慢性病性贫血の铁代谢:血清铁及总铁结合力降低、铁蛋白升高是慢性病贫血的特征性表现。血清铁半衰期为90分钟,变化迅速,可在感染开始或者严重炎症反应数小时后出现。总铁结合力常常反映转铁蛋白水平,转铁蛋白半衰期8-12天,变化较血清铁缓慢,可正常或轻度降低。血清铁蛋白水平反映铁储备,在慢性病贫血中升高、缺铁性贫血中降低,但作为急性时相蛋白,在炎症刺激后升高,受疾病状态影响较大,且长期慢性病贫血患者可出现铁储备下降,合并缺铁性贫血(慢性病性贫血铁蛋白浓度<60ug/L认为合并缺铁性贫血)。可溶性转铁蛋白受体是转铁蛋白膜受体片段的分解产物,当铁供给减少时升高,而在慢性病性贫血中因为合并炎症因子的负调节作用则正常或减少。
最后编辑于 2022-10-09 · 浏览 1.6 万