父母因素对单胎小体型脆弱新生儿的影响 :一项5年回顾性队列研究
本文推荐引用格式:
李静, 梁旭霞, 张继红, 张春, 卢燕群, 邬华. 父母因素对单胎小体型脆弱新生儿的影响:一项5年回顾性队列研究[J]. 临床儿科杂志, 2025, 43(11): 807-815 DOI:10.12372/jcp.2025.25e0402
LI Jing, LIANG Xuxia, ZHANG Jihong, ZHANG Chun, LU Yanqun, WU Hua. Parental factors associated with singleton small vulnerable neonates: a 5-year retrospective cohort study[J]. Journal of Clinical Pediatrics, 2025, 43(11): 807-815 DOI:10.12372/jcp. 2025.25e0402
本文作者:李 静 梁旭霞 张继红 张 春 卢燕群 邬 华
作者单位:广西医学科学院 广西壮族自治区人民医院产科(广西壮族自治区南宁 530021)
摘要:目的 探讨单胎小体型脆弱新生儿(SVN)的发病率变化趋势及其影响因素,分析父母因素与SVN的关联。方法 采用回顾性队列研究,选取2019年1月至2023年12月早孕期(孕14周前)在产科建档并定期产检至分娩的13020名孕妇作为研究对象。根据新生儿状况,符合SVN定义的纳入SVN组,其余纳入对照组。SVN包括早产(PT)、小于胎龄儿(SGA)和低出生体重儿(LBW)3种表型。比较两组孕妇基线资料、孕期并发症、父亲年龄和体质指数(BMI),以及妊娠结局,并采用logistic回归分析SVN的父母影响因素。结果 研究期间单胎分娩新生儿13020名,其中SVN 1658例,发病率为12.73%;SVN的3种表型PT、LBW和SGA分别为412、329、1246例,发病率为3.16%、2.53%和9.57%。PT和LBW的发病率,2023年较2019年分别下降了49.12%和29.73%,但SGA发病率2023年较2019年升高了37.04%。所有孕妇中,壮族占所有种族37.55%,本科及以上学历占82.33%,经产妇48.21%。孕前有疾病史的累计719例(5.52%),甲状腺功能异常最多(4.21%,548/13020)。3582名孕妇在孕前行地中海贫血(简称“地贫”)相关基因检测,1864例检出阳性(检出率52.04%),其中轻型α地贫检出率最高(674例,18.82%)。父亲≥35岁者占比37.08%,超重及肥胖(BMI≥24 kg/m2)占比50.53%,消瘦仅占2.73%。多因素logistic回归分析显示,母亲孕前超重、经产妇、AB血型为SVN的保护性因素(P<0.05);母亲孕前消瘦,妊娠合并多囊卵巢综合征(PCOS),妊娠期高血压疾病(HDP)为SVN的危险因素(P<0.05)。SVN组新生儿胎龄较小、身长较短、体重较轻,新生儿窒息及死亡率较高,与对照组的差异有统计学意义(P<0.05)。结论 SVN的3种表型在5年间的发病率变化趋势不同,SGA的发病率有升高趋势,应重点关注。SVN发生与母亲孕前营养状态、合并PCOS,孕期HDP密切相关,故应加强围产期保健、预防孕期HDP。本研究并未发现父亲年龄及BMI对SVN产生具体影响。
关键词:小体型脆弱新生儿;早产;低出生体重;小于胎龄儿;队列研究
小体型脆弱新生儿(small vulnerable newborn,SVN)是高危新生儿的一种新分类框架,包括早产(preterm,PT)、小于胎龄儿(small for gestational age,SGA)、低出生体重(low birth weight,LBW)儿3种不同的临床表型,SVN是导致新生儿死亡的主要原因[1]。根据世界卫生组织(WHO)与联合国儿童基金会(UNICEF)联合发布的全球早产儿报告[2]中显示,2020年全球活产儿中PT(<37周)占9.9%(1340万例),SGA占17.4%(2340万例),其中发展中国家贡献了85%的SVN。SVN 主要增加新生儿呼吸窘迫、脑损伤、感染及代谢异常的风险,且导致子代远期神经发育障碍,以及长期慢性疾病[3-6]。因此,SVN的防控已成为实现全球可持续发展目标的关键挑战。已有研究关注单一表型的影响因素,尚无父亲因素对SVN的作用,且缺乏广西地区研究的数据。因此,本研究分析广西地区父母因素对SVN的影响,旨在为制定符合当地精准化干预SVN的策略提供循证依据。
1 对象与方法
1.1 研究对象
本研究为单中心回顾性队列研究。选取2019年1 月至2023年12月早孕期(孕14周前)在广西壮族自治区人民医院产科建档,规范产检至分娩的13020名孕妇作为研究对象。纳入标准:①单胎;②分娩孕周28+0~41+6周;③孕期及分娩资料完整可查。排除标准:①胎儿染色体异常或结构畸形;②医学原因治疗性引产;③经临床诊断或影像学检查确认存在胎盘病理学改变的孕妇;④患有严重精神疾病不能配合者。
1.2 方法
1.2.1 资料收集 由本课题组专门人员收集和录入,并隐去研究对象姓名、身份信息。收集基线数据包括孕妇人口学特征,包括年龄、民族、孕前体质指数(BMI)、教育程度、婚姻状况、职业,临床特征包括受孕方式、产次、血型、地中海贫血(简称地贫)基因携带、吸烟、饮酒、既往病史和糖尿病家族史;以及孕妇早孕建档时父亲年龄和体型参数(身高、体重和BMI)。收集常见孕期并发症情况,包括妊娠期高血压疾病(hypertensive disorders of pregnancy,HDP)和妊娠期糖尿病(gestational diabetes mellitus,GDM)。随访至分娩,收集分娩孕周、分娩方式,新生儿体重、性别、Apgar评分以及脐血pH值水平。
1.2.2 SVN诊断标准 SVN定义[1]:包括新生儿分娩孕龄<37周(即PT)、出生体重低于同性别同胎龄第10百分位(即SGA)和出生体重< 2500 g(即LBW),符合任一条件的新生儿即被定义为SVN。
1.2.3 其他相关诊断标准或定义 根据中国不同出生胎龄新生儿体重及性别,体重低于同胎龄新生儿平均体重第10百分位诊断为SGA;出生体重高于同胎龄新生儿体重的第90百分位诊断为大于胎龄儿(large for gestational age,LGA);出生体重在同胎龄介于第10至第90百分位之间的定义为适于胎龄儿(appropriate for gestational age,AGA)[7]。新生儿窒息、胎儿酸血症、死胎、妊娠合并心脏病、HDP、多囊卵巢综合征(PCOS)、妊娠合并甲状腺疾病定义参考《妇产科学》第10版[8]。孕前糖尿病(PGDM)与GDM诊断标准参照《妊娠期高血糖诊治指南(2022)[第一部分]》[9]。自身免疫疾病是指机体产生高滴度自身抗体和/或自身反应性淋巴细胞攻击自身正常细胞和组织,导致组织器官损伤,累及多系统器官功能的一组疾病[10]。BMI分级[11]:<18.5kg/m2为消瘦,18.5~24kg/m2为体型正常,24~28kg/m2为超重,≥28 kg/m2为肥胖。
1.2.4 分组 随访至分娩,根据新生儿状况,符合SVN定义的纳入SVN组;对照组为足月分娩,非SGA或LBW的新生儿。SVN组1658例,包括PT、SGA和LBW 3种表型;对照组11362例。
1.3 统计学分析
采用R3.6.1软件进行数据处理及统计学分析。计量资料符合正态分布的以x±s表示,两组间比较采用两独立样本t检验;非正态分布的以M(P25~P75)表示,两组间比较采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。采用单因素及多因素logistic回归分析SVN的影响因素。采用RCS回归探讨父亲年龄、BMI和SVN的非线性关系。以P<0.05为差异有统计学意义。
2 结果
2.1 2019—2023年SVN的流行病学情况
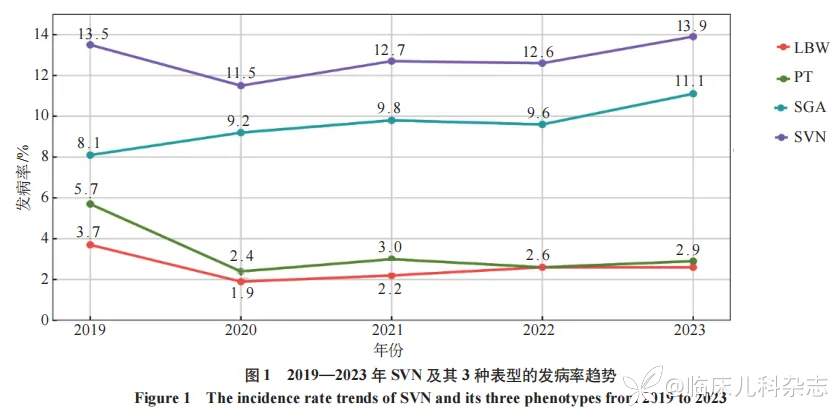
研究期间单胎分娩新生儿13020名,其中SVN 1658例,发病率为12.73%;SVN的3种表型PT、LBW和SGA分别为412、329、1246 例,发病率为3.16%、2.53% 和9.57%。PT和LBW的发病率,2023年较2019年分别下降了49.12%和29.73%,但SGA发病率2023年较2019年升高了37.04%。见图1。
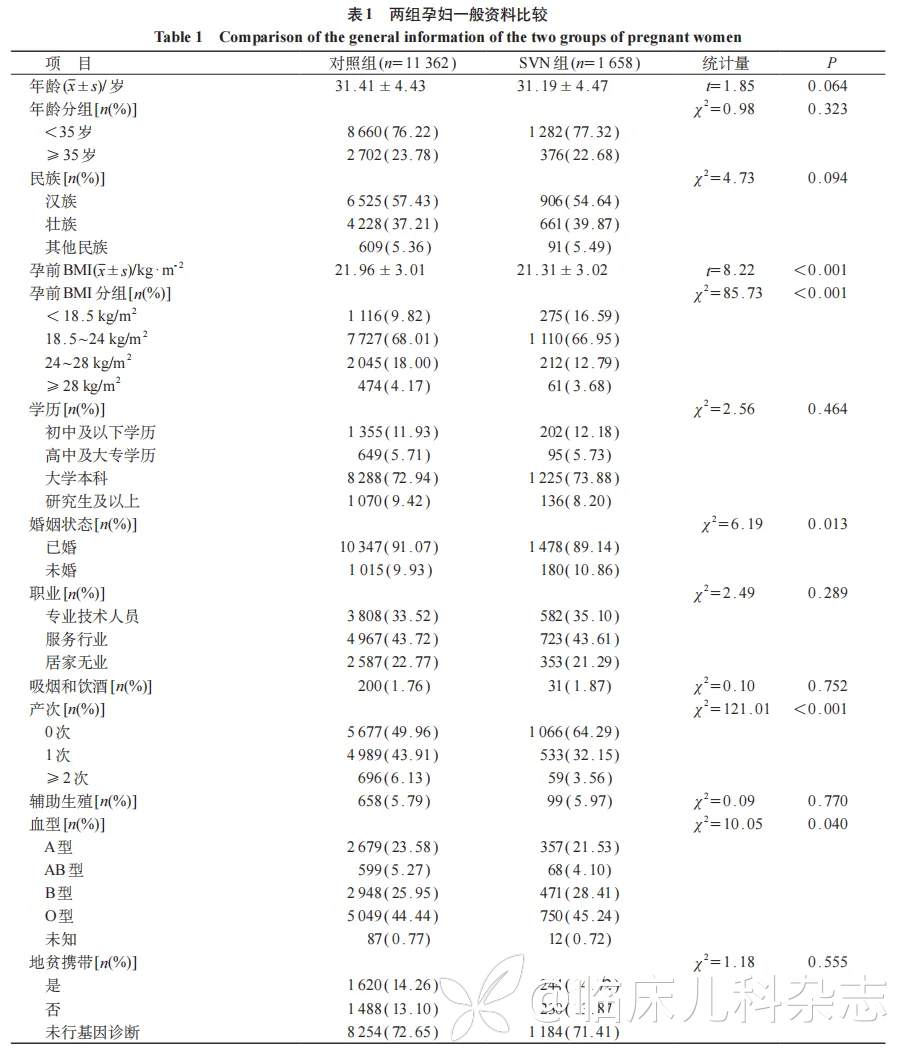
2.2 对照组和SVN组间孕妇一般资料比较
所有孕妇中,壮族占所有种族37.55%,本科及以上学历占82.33%,经产妇48.21%,无业孕妇22.58%。孕前有疾病史的累计719例(5.52%),甲状腺功能异常最多(4.21%,548/13020)。心脏病中先天性心脏病占46. 67%(21/45),其次为功能性心脏病(15例,33.33%)、心律失常(6例,13.33%)和风湿性心脏病(3例,6.67%)。见表1。
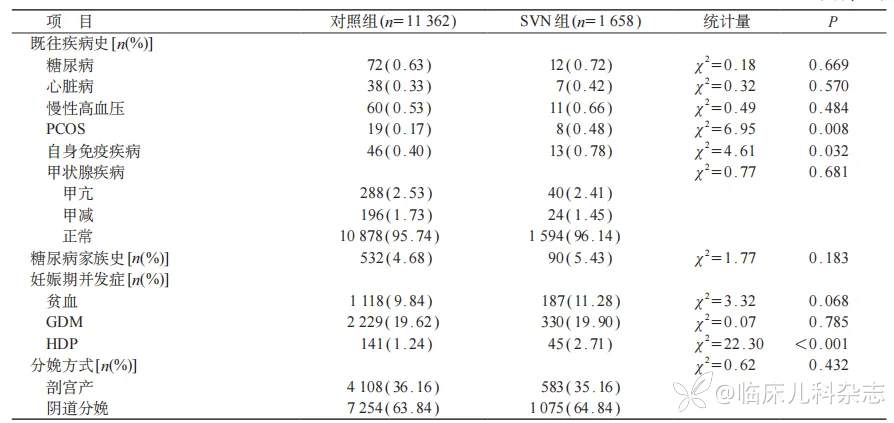
3582名孕妇在孕前行地中海贫血(简称“地贫”)相关基因检测,1864例检出阳性(阳性检出率52.04%),其中轻型α地贫检出率最高(674例,18.82%),其次为静止型α地贫(559例,15.61%),轻型β地贫(503例,14.04%),αβ复合型地贫(97例,2.71%),中间型地贫占比最低(31例,0.87%)。
对照组和SVN组两组间孕前BMI分级、婚姻状况、产次、血型类型分布差异均有统计学意义(P<0.05);与对照组相比,SVN组孕妇孕前BMI更低,有PCOS、自身免疫性疾病史的比例以及HDP发生率更高,差异均有统计学意义(P<0.05)。见表1。
2.3 对照组和SVN组间父亲一般资料比较
父亲≥35岁者占比37.08%,超重及肥胖(BMI≥24 kg/m2)占比50.53%,消瘦仅占2.73%。与对照组比较,SVN组父亲年龄较小,BMI较低,差异有统计学意义(P<0.01)。见表2。
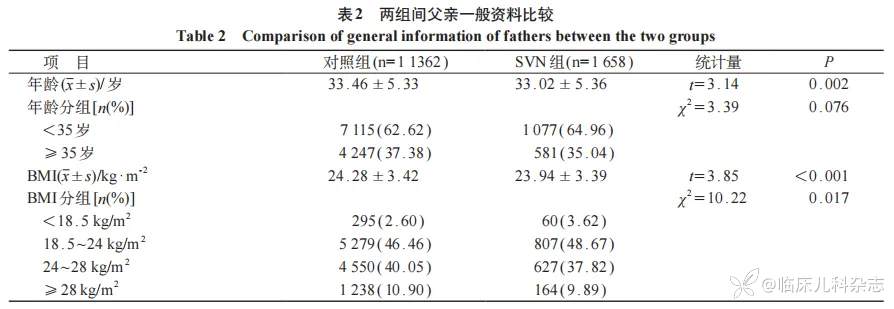
因样本量大,计算两组年龄和BMI的Cohen’s d值,分别为0.101(95%CI:0.050~0.153)和0.083(95%CI:0.031~0.134),由于Cohen’s d值<2,提示两组间差异小。
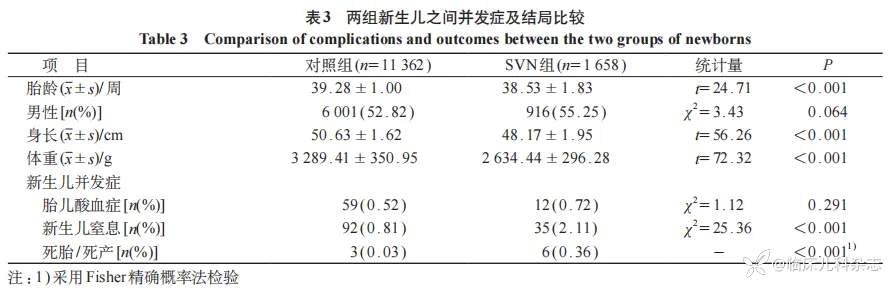
2.4 两组新生儿并发症及结局比较
所有新生儿平均胎龄为(39.18±1.17)周,女婴46.87%,男婴53.13%,平均身长(50.31±1.83)cm,平均体重(3206±408)g,新生儿窒息率为0.98%,死胎/死产率为0.07%。SVN组新生儿胎龄较小、身长较短、体重较轻,新生儿窒息及死亡率较高,与对照组的差异有统计学意义(P<0.05)。见表3。
2.5 Logistic回归分析SVN的影响因素
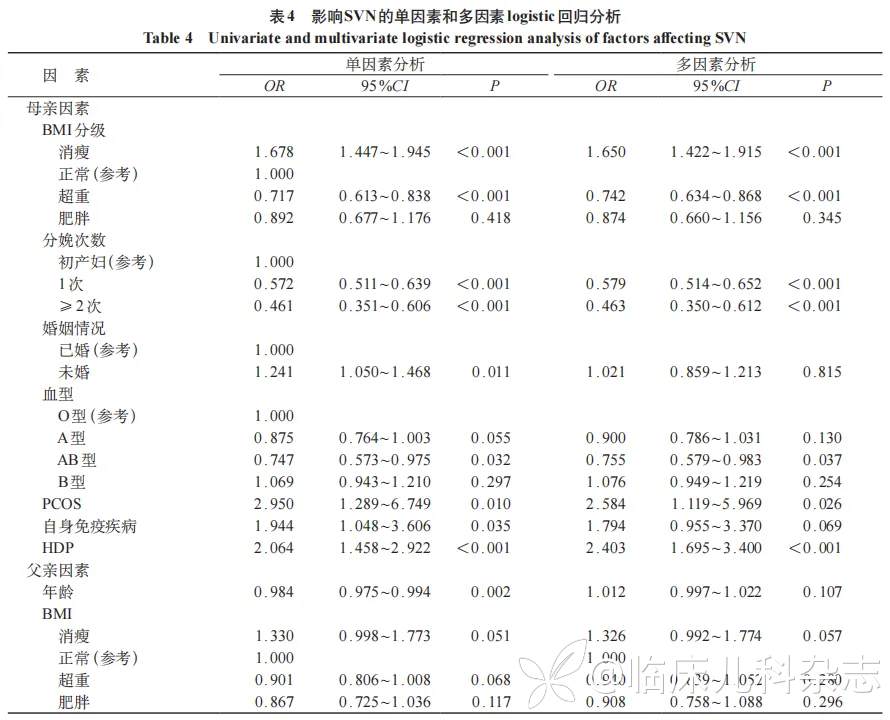
将SVN组和对照组比较有统计学意义的变量纳入单因素和多因素回归分析。单因素分析发现母亲孕前超重、经产妇、AB血型及父亲年龄增加是SVN的保护性因素(P<0.05);母亲孕前消瘦、未婚、有PCOS史,自身免疫性疾病史以及孕期并发HDP是SVN的危险因素(P<0.05)。
多因素分析显示,母亲孕前超重、经产妇、AB血型为SVN的保护性因素(P<0.05);母亲孕前消瘦,妊娠合并PCOS,孕期并发HDP为SVN的危险因素(P<0.05)。见表4。RCS回归结果显示父亲年龄和BMI与SVN呈线性负相关(P<0.01),但不存在非线性关系(P=0.317、0.270)。
3 讨论
SVN是近年来针对高危新生儿的提出的一个新的概念框架,涵盖了PT、SGA和LBW三个表型,其可能存在共同的病因,如母亲营养不良、感染、环境暴露等因素,且导致子代相似的不良结局,如新生儿死亡、长期健康风险等[12]。SVN提供了一个更全面的视角来评估高危新生儿的社会经济负担[1]。据全球研究,2020年SVN的发生率为26.2%,中低收入国家SVN发生率和死亡率高于高收入国家,尤其是撒哈拉以南非洲和南亚地区,具有地域差异[13]。中国缺乏全国性调查,北京地区流行病学数据显示,2013年至2022年SVN发生率为9.94%,显著低于全球平均水平,但呈上升趋势(从9.82%增加到10.96%)[14]。因此,本研究聚焦壮族聚居地广西南宁,分析父母部分人口学特征、母亲孕前合并症及孕期并发症(GDM和HDP)对SVN的影响,为SVN风险分层管理,实现精准预防策略提供循证依据。
本研究发现SVN的发生率为12.73%,5年间波动于11.5%~13.9%,当单纯依据PT或LBW识别高危儿可能导致约80%的SVN漏诊,SGA也可造成约25%的漏诊风险。一项针对发展中国家的研究显示,PT、SGA和LBW的患病率分别为12%、16.1%和9.8%[15]。我国一项全国范围的流行病学调查显示SGA的发病率呈现地区差异,西部地区最高8.3%,东部地区最低2.3%[16]。本研究PT、SGA和LBW的发病率显著低于发展中国家的水平,但SGA的发病率与该报道基本相符。与北京地区比较,本研究中不同表型具有显著差异性,PT(3.16%对6.34%)和LBW(2.50%对4.8%)明显低于北京地区,而SGA(9.57%对4. 51%)则高于北京地区[14],提示本地区应优先强化SGA的干预。
本研究显示壮族孕妇占37.55%,仅次于汉族(57.07%),地贫的检出率为52.04%,以α地贫为主(674,18.82%),经产妇约48%。本科以上学历孕妇占80%以上,约90%已婚,此调查结果与中国出生队列(the China birth cohort study,CBCS)发现的孕妇产次、学历和婚姻状况相似,但后者以汉族孕妇为主要调查对象(>93%)[17]。本研究孕妇教育水平明显高于国家统计局2021年发布的数据(2020年我国人口大专及以上学历占15.47%)[18],考虑本研究中心位于广西首府,就诊孕妇主要居住于市区,相对受教育程度较高。本研究既往疾病史孕妇累计约6%,其中合并甲状腺疾病患病率占比超过一半,应着重宣传本地区育龄女性孕前甲状腺功能的筛查。另本研究孕妇既往患有慢性高血压(0.55%对0.32%)和糖尿病的概率(0.65%对0.26%)均高于全国水平[17],故应该重视孕前或早孕期妇女血糖、血压的检测,加强孕期干预。
比较父母特征发现,父亲年龄([33.4±5.34)岁]大于母亲([31.38±4.44)岁],≥35岁占比父母分别为37.08%和23.64%,高于全国水平2倍多 [17],父亲超重及肥胖比例高于母亲(50.53%对21.44%),亦略高于全国水平[17]。因此,孕期不仅应重视孕妇营养及健康生活方式的宣教,将配偶健康生活方式的指导纳入孕期管理目标,有利于改善以家庭为单位的群体健康水平,并提高孕妇的家庭支持。
本研究发现母亲消瘦、未婚、孕前PCOS、自身免疫性疾病及孕期HDP是SVN的危险因素;而母亲超重、经产妇、AB血型和父亲年龄是SVN的保护性因素。多因素分析后,除母亲未婚、合并自身免疫性疾病史和父亲年龄外,其余影响因素仍显著。
国外学者研究发现消瘦(BMI<18.5kg/m2)(aRR=1.44,95%CI:1.27~1.64),子痫前期(aRR=1.48,95%CI:1.30~1.71)增加SGA风险[19]。我国北京地区的研究[14]发现高龄(aOR=1.23,95%CI:1.22~1.25)和初产(aOR=1.31,95%CI:1.29~1.32)是SVN的高危因素[15]。Xiang等[16]比较单胎足月SGA与AGA孕妇,发现分娩SGA的产妇年龄较低、孕前BMI较小,多为初产妇。以上研究结果大致与本研究一致,考虑母亲消瘦反映营养状态不良,初产妇孕期保健意识可能差于经产妇。HDP,尤其子痫前期孕妇胎盘螺旋动脉重塑不良,导致胎盘缺血缺氧,释放促炎因子(如IL-6、TNF-α)和抗血管生成因子(如sFlt-1),增加SVN风险[20-21]。尽管本研究发现AB血型与SVN风险降低相关(OR=0.755,95%CI:0.579~0.983,P=0.037),但孕妇血型与SVN的研究目前鲜有,未来需要进一步针对本地区孕妇的特征,研究血型对于SVN及其不同表型影响的机制。
孕妇既往患有PCOS对SVN不同表型的影响研究结论尚不确切,已有研究证实PCOS患者尤其合并代谢并发症(如糖尿病和高血压)时显著增加PT风险,但在BMI正常范围的PCOS患者中,SGA的风险无显著差异,考虑肥胖和高雄激素水平可能是导致SVN及其各表型的潜在机制,因雄激素过高可能影响胎盘功能,导致胎盘血管重塑异常;胰岛素抵抗与高胰岛素血症可引发血管内皮功能障碍,增加GDM和肥胖孕妇糖脂代谢紊乱,诱发全身慢性低度炎症反应,诱发早产,增加LBW和SGA风险[22-24]。
父亲因素对于新生儿结局的影响日益受到关注,本研究结果显示父亲年龄及BMI与SVN呈微弱负相关,但并未证实父亲年龄及BMI对SVN的具体影响和因果关系。既往研究关于父亲人体测量学指标(如身高、体重或BMI)与SVN三种不同表型的关系仍有争议,全基因组关联研究(GWAS)显示父亲身高相关基因(如HMGA2、LCORL)可能通过胎儿遗传效应增加新生儿体重和身长[25-26]。Ma等[27]则发现如果父亲超重及肥胖,其新生儿的体重也显著增加,但也有研究认为父亲BMI与早产、LBW无直接关联[28]。父亲对子代的影响因素可能被母亲营养状况、孕前疾病、孕期并发症或社会经济学因素掩盖,未来应将父亲体型参数纳入围产期风险评估的体系。
本研究存在一些不足之处。本研究为回顾性设计,未能对孕妇既往疾病以及妊娠期合并症的疾病管理状况进行准确评估。未测量的混杂因素,如环境暴露,家庭社会经济细节等未纳入分析。另外,采用孕妇产检及产时电子病历系统收集资料,新生儿数据缺失较多,无法对新生儿呼吸、神经系统及代谢疾病等重要结局进行分析。最后,本研究为单中心数据,可能无法推广至其他地区或医疗水平差异较大的群体。
综上,SVN新框架下PT、SGA和LBW三种表型是导致新生儿不良结局的核心,SVN能更准确概括高危儿的全貌,提供更全面的公共卫生视角。通过对本中心五年期间SVN的回顾性研究,及父母影响因素的分析,为本地区新生儿健康监测和干预提供更科学的循证依据。
参考文献:略。
















































