大师兄带你读文献—看这篇19.4分的JCI如何定义一种新的免疫细胞!

背景介绍
血小板是血栓形成的主要介质,但近年来发现血小板也具有免疫调节功能,肺部的巨核细胞(MK)是循环血小板的主要来源,且肺部MK比骨髓MK表达更多 的免疫调节分子,但肺部MK的免疫调节功能仍不清楚。
结果解读
1、肺部和骨髓MK的表型不同
为了证明肺部MK的存在,作者首先分别在小鼠、猴子肺部切片中检测了CD41c的表达,证实肺部存在巨核细胞。进一步通过流式发现,肺部的MK主要包含血管内和血管外MK,其中60%属于血管外MK。相比于骨髓,肺部MK以2倍体为主,肺部和骨髓MK具有类似的产生血小板的能力。
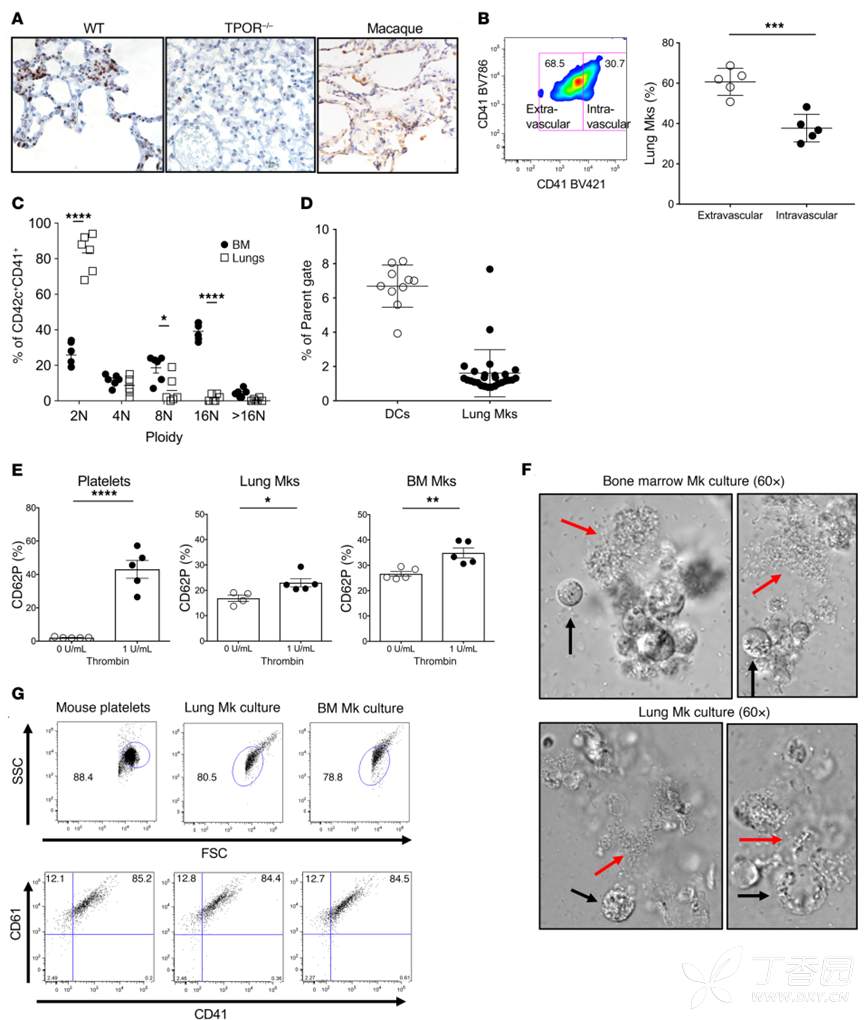
2、骨髓和肺部免疫相关分子的表达
为了进一步探究BM与肺部MK的表型差异,作者进行了单细胞测序(肺MK、骨髓MK、肺其他髓系、骨髓其他髓系),聚类分析显示,相比于骨髓MK,肺部MK(MKs单细胞手工注释marker:Pf4, Itga2b, Ppbp, Itgb3, Gp9, and Cxcr4)与DC距离更近。进一步的基因表达结果显示,肺部MK表达大量的与DC相关的免疫分子(MHCII、CD11c),流式细胞术的结果也证实了这一点。相比于BM的MK,肺部MK表达更多的抗原提呈细胞(APC)的marker(MHC II, CD80, CD40, ICAM-1, LFA-1和CCR7)。
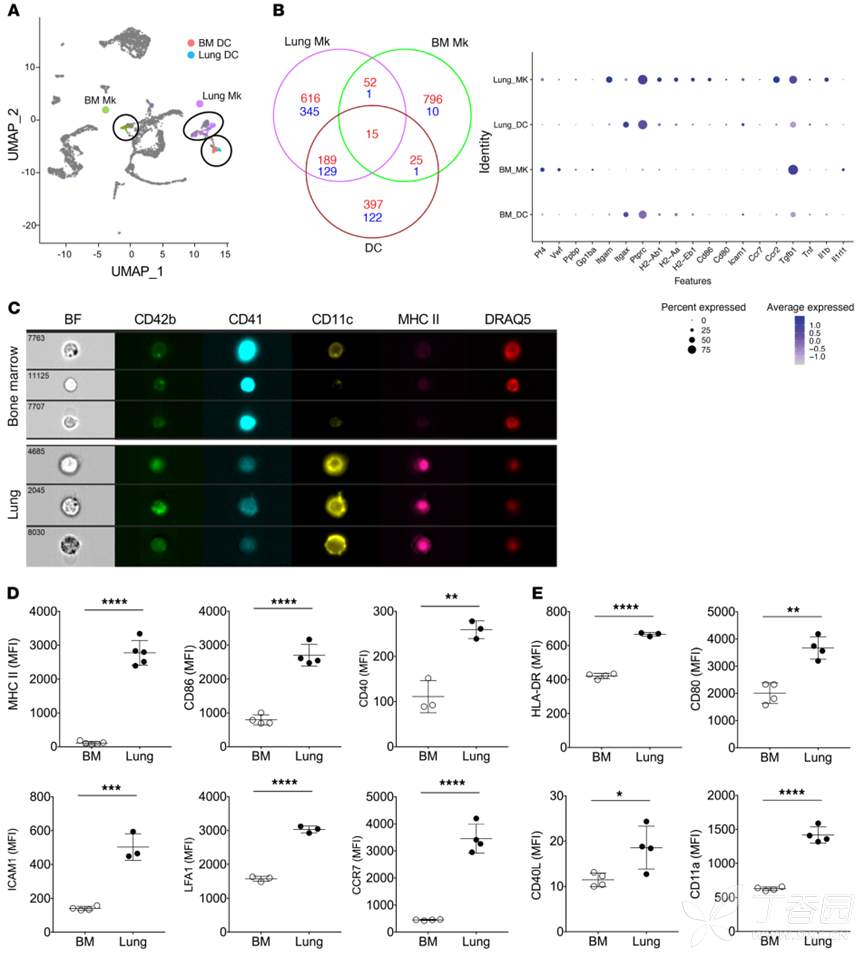
3、肺部MK的表型受环境调控
肺部和骨髓的微环境完全不同。骨髓是一个相对无菌、低氧、免疫抑制的微环境,而肺部无时无刻都在面对病原体的挑战,并且富含氧气。接下来,作者进一步探究肺部和骨髓MK的差异是否是由于微环境的差异导致的?作者将新生小鼠和成年小鼠的肺部MK进行比较,发现,成年小鼠肺部MK表达MHC与ICAM1水平更高,这也证实了作者的猜想!接下来,作者利用不同的toll like 受体激活剂体外刺激MK,发现LPS、CpG、IFN-γ均可诱导MK高表达MHCII和ICAM1,而polyI:C不能。且低氧和常氧下,MK的MHC表达不受影响,这说明肺部与骨髓MK的表型差异不是由氧气含量不同导致的,而是肺部其他因子导致的。接下来,为了确定肺部MK的这种免疫激活是否持久或可塑性,作者利用CpG刺激MK,发现短期内MHC和ICAM1上调,而刺激6天后,这些免疫分子则检测不到了,这些数据进一步表明,MK的免疫可塑性与其他免疫细胞相似。
肺和BM之间的细胞组成和细胞因子环境有很大差异。肺组织驻留细胞,如气道上皮细胞,分泌促进DC成熟的细胞因子,包括IL-33、IL-13和TSLP,而BM具有免疫抑制作用。结果显示,IL-33可以增加BM Mk MHC II和ICAM1的表达。

4、体内因子调控肺部MK的表型
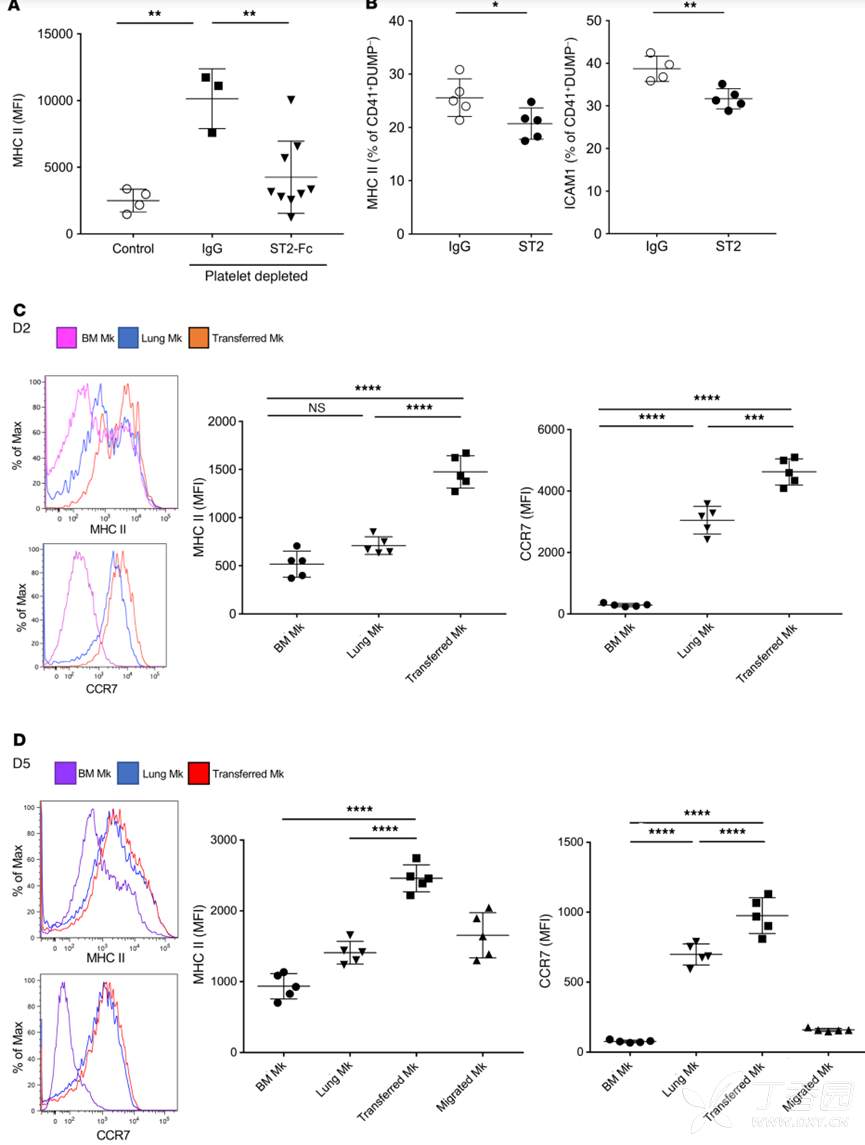
为了进一步体内探究IL-33对肺部MK的作用,作者首先利用CD42b抗体清除MK和血小板,然后利用单抗阻断IL-33,结果显示,阻断IL-33后,肺部MK的MHC及ICAM1表达显著降低。
为了进一步证明肺环境在Mk免疫分化中的作用,作者分离出BM MK,经荧光标记后通过口咽(o.p.)途径转移给受体小鼠,两天后进行流式检测转移的细胞,结果显示转入的BM MK在肺内获得肺部MK的免疫表型,包括MHC II和CCR7增加,表明肺环境可能决定了MK的免疫分化。在第5天,作者还发现一些肺转移的BM Mks迁移到BM中,但这些是迁移到骨髓的MK表达较少的MHC II和CCR7。总之,这些数据表明Mk表型在体内也是可塑的,并受组织环境的改变。
5、体外-肺部MK加工处理抗原
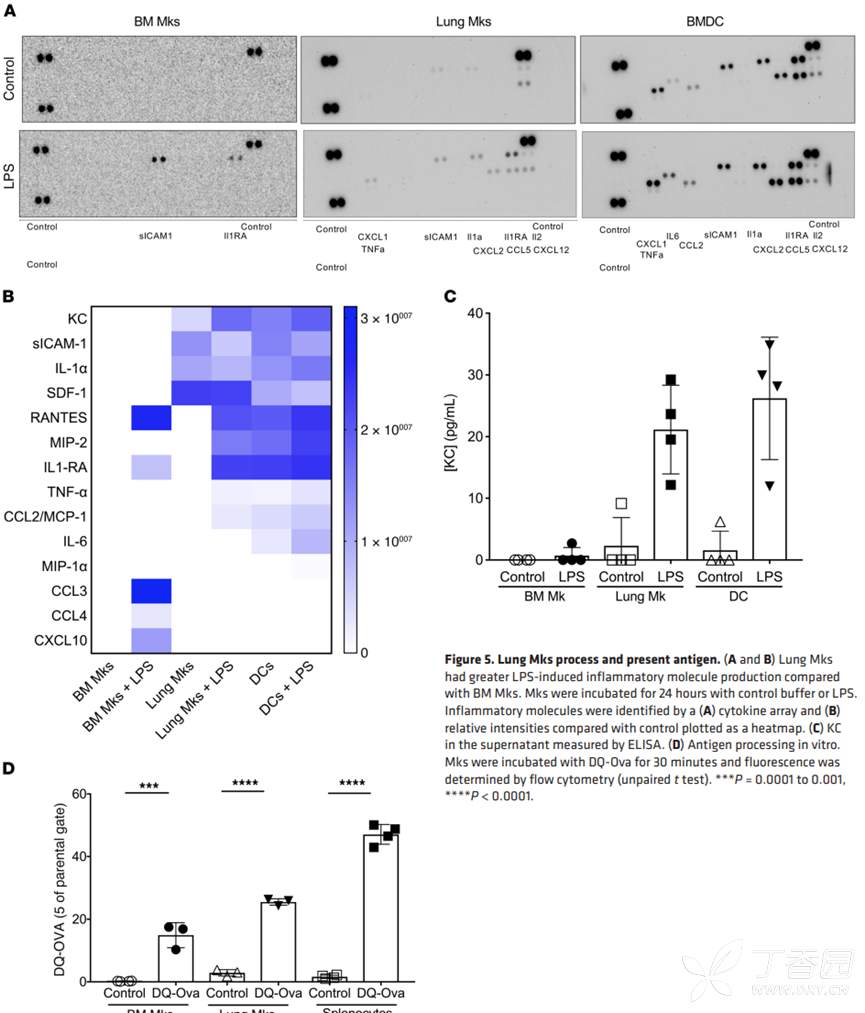
接下来,作者继续探究肺部MK和骨髓MK对免疫刺激的反应是否不同?利用LPS刺激肺部和骨髓MK,DC细胞作为对照。对细胞上清进行细胞因子芯片检测,发现肺部MK与DC一样,释放更多的免疫分子。
抗原提呈细胞可内化并加工抗原,并将抗原呈递给CD4T细胞。为了探究肺部MK是否能提呈抗原,作者将肺部MK与DQ-ovalbumin孵育,发现MK可以内化抗原。
6、体内-肺部MK参与加工处理抗原
为了进一步在体内证明MK可以加工处理抗原,作者将PF4-TDT小鼠进行LPS和DQ-OVA处理,结果显示肺部MK内存在DQ-OVA。为了进步一部观察肺部MK与骨髓MK对细菌的处理能力,作者利用GFP标记的大肠杆菌感染MK,发现肺部MK处理细菌能力更强。这些数据表明肺部MK可以发挥与DC类似的作用,加工处理抗原。
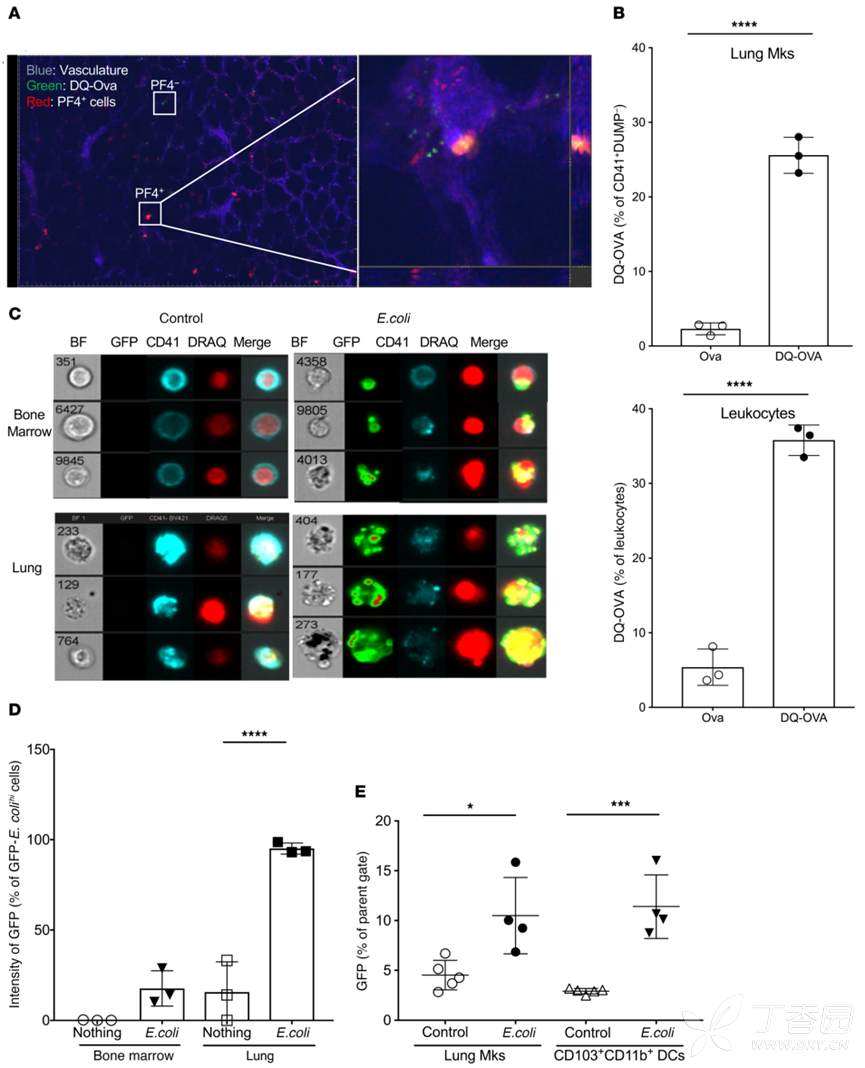
7、肺部MK参与提呈抗原
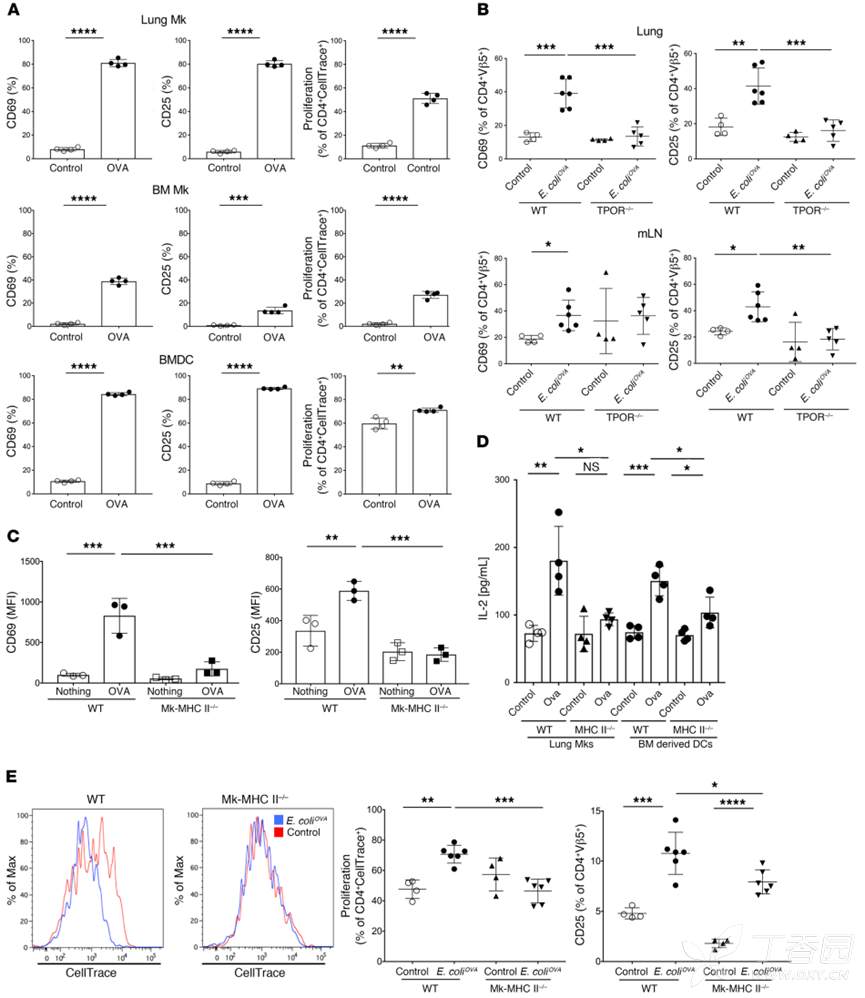
接下来,作者继续探究MK是否能将抗原提呈给CD4T细胞?分选的MK用LPS、OVA处理后,与OTII小鼠T细胞进行共培养,结果显示,相比于BM MK,肺部MK更能激活T细胞。为了体内进一步探究其作用,作者将OTII 小鼠T细胞转移至缺乏MK的TPOR–/–小鼠中,24小时后,感染ova-大肠杆菌,结果显示,WT感染小鼠的肺和淋巴结中OTII T细胞比tpo - / -小鼠更活化。表明,MkL可能调节CD4+ T细胞对肺部感染的反应。接下来,作者利用MHC KO小鼠进一步证明,肺部MK对T细胞的活化依赖于MHC分子。
全文总结
血小板虽然是血栓形成的细胞介质,但同时也是免疫细胞。血小板直接或间接地与免疫细胞相互作用,影响它们的激活和分化,以及免疫反应的所有阶段。巨核细胞(Mks)是循环血小板的细胞来源,通常只被认为是常驻骨髓(BM-resident)细胞。然而,近年发现产生血小板的Mks也存在于肺中。与BM Mks相比,肺Mks表达更高水平的免疫分子。因此,本文作者对肺Mks的免疫功能进行了探究。通过对BM和肺骨髓富集细胞进行单细胞RNA测序,发现肺Mks具有类似于抗原提呈细胞的基因表达模式。成像和常规流式细胞术也证实了这一点。并且,Mks的免疫表型是可塑的,受组织免疫环境驱动,BM Mks在病原体和肺相关免疫分子(如IL-33)的影响下具有肺部MK表型。体外和体内实验表明,肺部Mk内化和加工抗原蛋白和细菌。此外,肺部Mk可通过MHC II可诱导CD4+ T细胞活化。这些数据表明,MkL具有关键的免疫调节作用。
















































