小分子多肽(4KD)Western blot经验交流
 yj1984ren 推荐
yj1984ren 推荐一、目的蛋白
- 一种多肽(4KD左右)
二、所用试剂
- 上样缓冲液:SDS-PAGE loading buffer,4x(with DTT);公司:Solarbio
- marker:Prestained Protein Ladder;公司:Thermo Scientific
- 凝胶制备试剂:SDS-PAGE 凝胶制备试剂盒;公司:Solarbio
- BeyoBlue™考马斯亮蓝超快染色液;公司:Beyotime
三、试剂配置
- 电泳缓冲液(2L):Tris:6.06g + 甘氨酸:28.8g + SDS:2g → 溶于2L去离子水
- 转膜液(2L):Tris:6.06g + 甘氨酸:28.8g →溶解于1600ml去离子水 → 加400 ml甲醇
四、实验流程
- 制胶:15%分离胶,5%浓缩胶(按照SDS-PAGE 凝胶制备试剂盒说明书去配置)
- 点样:如图1所示
- 电泳:置于冰水上电泳;浓缩胶(80v,55min);分离胶(120v,47min)
- 转膜:220mA,30min(此处转膜是取右半部分去转膜,主要目的是想看看这个条件能不能把小分子转过去,然后转完膜,用PVDF膜来做考马斯亮蓝染色验证)
- 考马斯亮蓝染色:用电泳完左半部分的胶来做考马斯亮蓝染色(染色之前用去离子水洗涤3min,减少残留的SDS所增加染色背景,然后直接加考马斯亮蓝超快染色液,放在摇床上染色过夜)
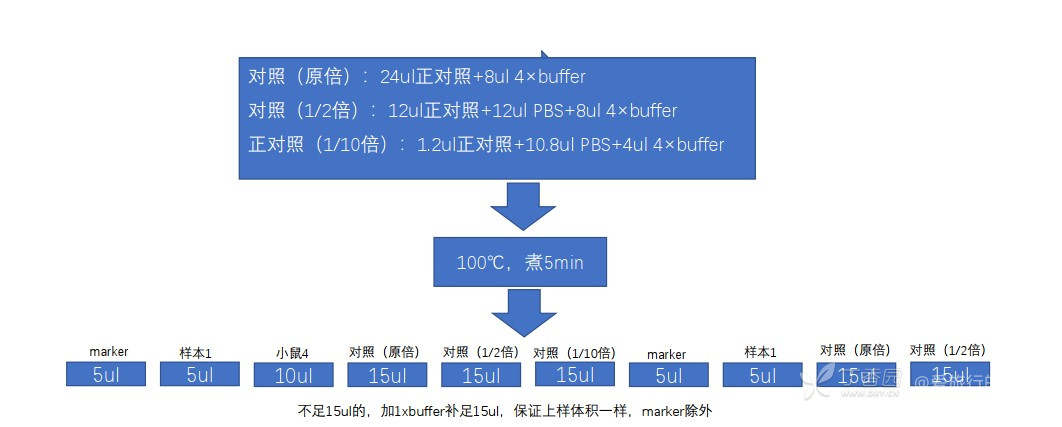
图1: 电泳上样
五、实验结果

图2:电泳以及转膜和转膜后的凝胶
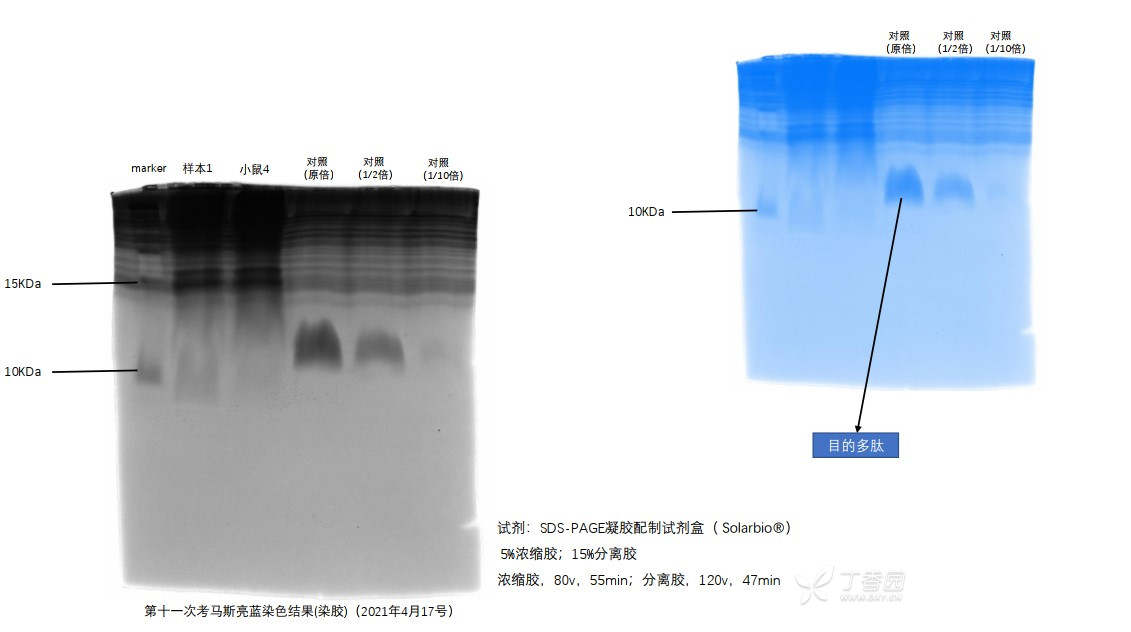
图3: 电泳完的凝胶做考马斯亮蓝染色的结果(分别为灰色和蓝色背景)
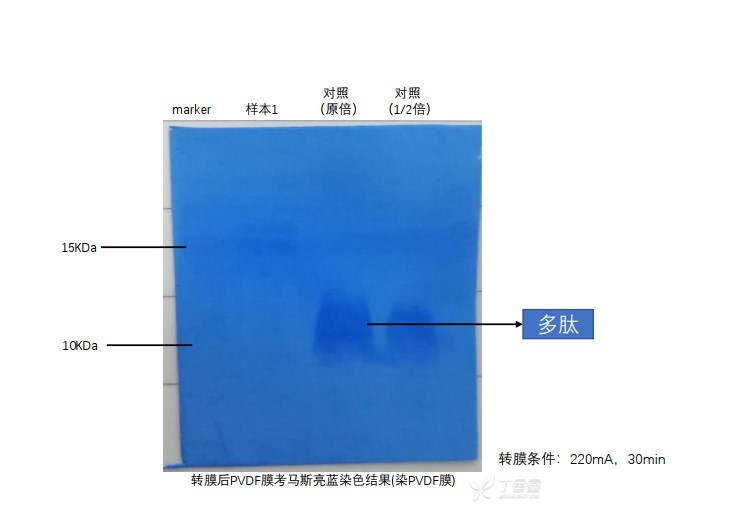
图4:转完膜,PVDF膜考马斯亮蓝染色的结果
六、实验分析与思考
- 虽然我老师说这个多肽只有4KD大小,但是加的正对照就只含有目的多肽,而且随着目的多肽稀释倍数的增加,黑色团块也慢慢变淡,由此可以确定对照泳道下面10KD附近的一团黑色就是目的多肽。
- 对照电泳成黑色的团块,是因为小分子多肽弥散导致的吗?上一次看到这个结果,首先怀疑是电泳时间过长导致的(上一次跑电泳的条件:分离胶的电泳时间是120v,125min,结果如图5所示),但是结果和这一次电泳(分离胶120v,47min)的结果感觉差别不大,都很弥散,所以我在考虑,这个小分子多肽的弥散跟电泳时间没有多大的关系,主要是这种传统胶无法避免的?(但是实验室的师兄有用过传统的10%分离胶跑出过4KD的小分子蛋白)。
- 怎样改进条件才能跑出一条完整的目的条带(就是怎么减少小分子多肽在电泳时候的弥散)?我看到网上说小分子蛋白要用trince胶来跑,但是这个还没有深入了解过,主要是实验室的师兄之前有用过普通的胶也跑出过小分子蛋白,所以目前暂时不考虑换其他胶,想继续改进一下条件试一下。
- 我的marker最小标记条带是10KD(绿色的),但是marker颜色的大小会和蛋白实际的大小会有出入吗?因为我感觉对照的位置还是偏上了一些。
- 最后一点,也是很疑惑的一点,就是我电泳完的胶,用考马斯亮蓝染色,为什么总是看到一条不是很明显得线(就是泳道不分明,连成了一条线),如图3所示,对照的泳道在大分子位置处也出现了很多一条条黑线,和其他样本连在一起(正常对照只含有一种蛋白,不会出现这么多条带),所以我就非常疑惑,这是什么原因导致的?

图5:上一次电泳(分离胶120v,125min)凝胶考马染色结果
以上就是我的一些实验过程、实验结果,以及一些困扰的问题
希望有跑过小分子蛋白的朋友给点建议啊,非常非常非常感谢!!!!!!!!!





















































