你说,这些RNA提取问题,你遇到过哪个?小师妹说全中!
实验汪应该都已经习惯了一种痛苦,叫做 RNA 提取:
- 只要一做 RNA 提取,一天到晚提心吊胆,操作步骤繁多姑且不说,研磨、抽提、离心,一天忙到晚,结果一检测,啥都没有…
- 最近好不容易论文到了查重阶段,也是一顿操作猛如虎,一看查重二百五…
- RNA 提取到底是怎么了?删了两千多字,改的快跟小学生一样了,还是一片红...关键是,无论怎么看和别人重复的内容,都没在其他文章里看过啊,问题到底出在哪?
这些非常容易忽视的问题,你遇到过哪个,应该如何解决?
1.RNA「热化了」
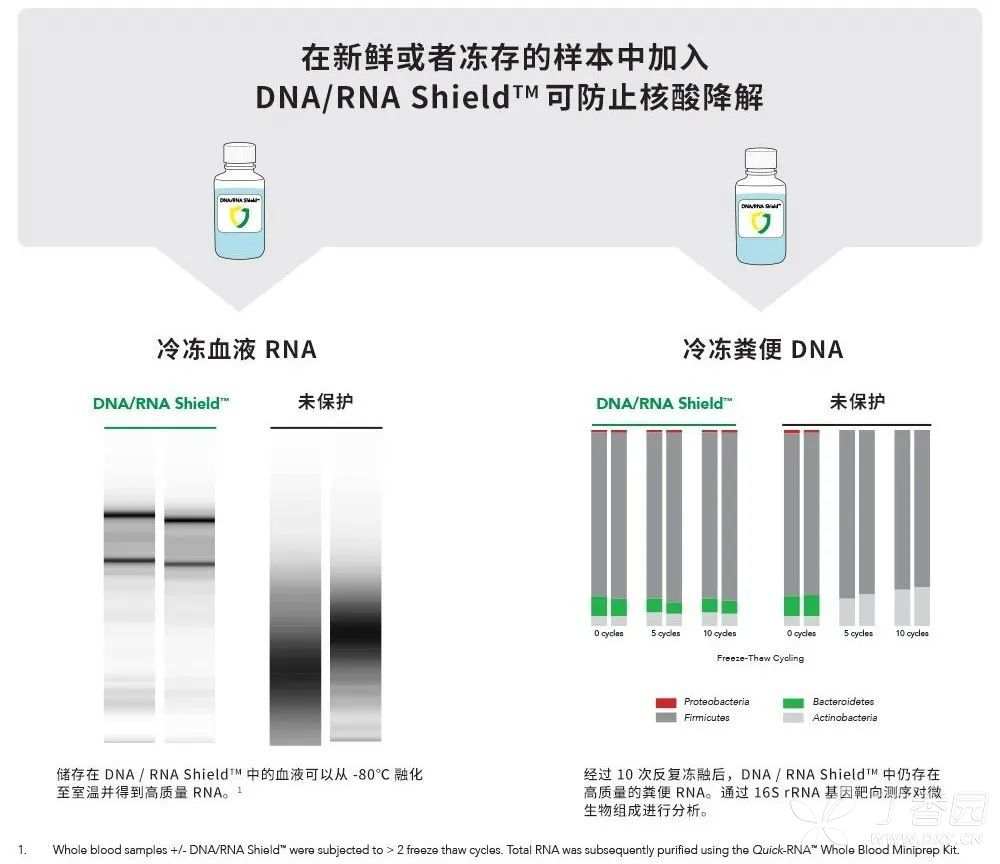
因单链结构,RNA 非常不稳定,需要用超低温抑制 RNA 酶的活性。为了防止 RNA「热化了」,经常使用大量液氮充分研磨样品,或者在冷冻室内储存。但往往 RNA 又经不起冻,怎么办呢?
可将样品浸泡在稳定试剂中,致使 RNA 酶失活,在采集时就保留样品的基因完整性。这方面 DNA/RNA Shield 可以储存各种类型的样品,在环境温度下也可运输。冷链不再是必须的,进行敏感的下游分析当然更加靠谱 ~
2.做实验的「感染了」
病毒 RNA 在提取后也仍然具有传染性,在提取时,实验人员需要佩戴口罩和手套等各种防护装备,以防实验室污染。而有种「自动灭活」的方法,在更加便利的同时,也能更好的保护实验人员的安全。
遵守美国疾病控制中心(CDC)的病原体灭活指南,DNA/RNA Shield 可裂解并有效灭活样品中的病原体,包括最坚韧的病毒也不在话下。

3.RNA「发酶了」
许多样品中含有高水平的 RNase,这种酶也会加速 RNA 的降解。为了使这种酶对降解的影响最小化,最好在采集时就稳定好样本中的 RNA。
这种情况下,可以在裂解缓冲液中立即进行溶解。比如可以通过 TRIzol®、RNA 裂解缓冲液等使 RNase 失活,然后再处理样本。另外,再采集样本之后马上加入 DNA/RNA Shield,可以快速降解掉 RNase 等蛋白物质。当然,DNA/RNA Shield 也会保证取样时微生物基因多样性不会发生改变。

4.RNA「难产了」
RNA 的产量和质量也是另无数人头疼的问题,最佳方法是保证样品完全裂解,但相同的裂解方案换了一个样本可能就没辙了。
为了提高裂解效果,可以将裂解缓冲液与机械裂解步骤(研磨珠破碎)匹配,或者在裂解液上游加入酶裂解步骤(如蛋白酶 K、溶菌酶等)。
5.「黑化的」DNA
DNA 的存在会使基于 UV/VIS 的定量方法(如 Nanodrop)发生偏差,从而人为地提高 RNA 的定量,使其高于实际水平。在更敏感的下游应用(例如 RNA-seq)中,DNA 还可能导致错误读数,这样的 DNA 简直就是「黑化的」了!
这种问题可以通过 TRIzol® 相分离、DNA 去除柱、DNase 处理等多种方法解决。同时,确认 DNA 存在的最快方法是使 RNA 样本可视化(如琼脂糖凝胶,AgilentTapeStation® 等等), 寻找 28S 核糖体 RNA 带上方的任何高分子量片段。
当然,通过 qPCR 或 Qubit 等方法也可以实现,若正在执行对 DNA 污染敏感的下游应用,这种方法则更可取。
由 Zymo Research 开发的新型 RNA 提取试剂盒,也能达到消除 DNA 污染的目的。该试剂盒具有新的缓冲液和离心柱体系,包括用于柱上处理的 DNase I,可以结合和提取 RNA。并且消除了提取后 DNA 酶处理和清理步骤的需要,简化了从提取到下游应用的过程。
看到这里,你对 RNA 提取的信心是不是重新回来了!
















































