保守治疗无效的“炎症”咯血要警惕肺癌!
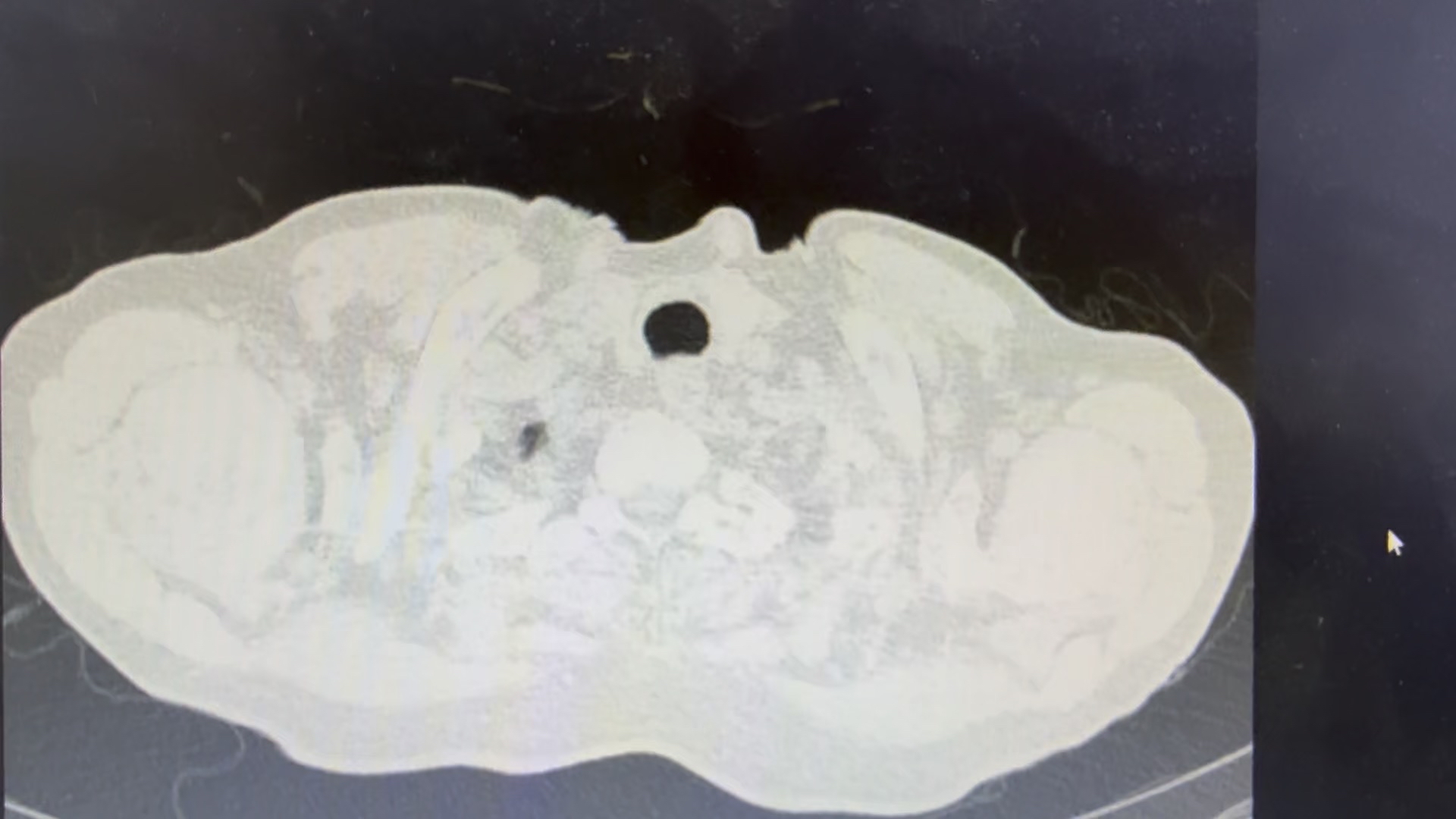

术前CT

选择片状阴影中呈块状部位进行活检

后路进针步骤

主体病灶冷冻冰球覆盖

冷冻灭活后再负压活检

切割活检后完整组织标本

像蚯蚓一样的活检组织标本

活检时吸出体外的组织液(鲜血)

被负压球吸出体外的病灶内组织液标本

组织液标本

针眼创伤

术后即刻起床

组织液标本NGS未发现感染证据

组织标本提示中低分化腺癌
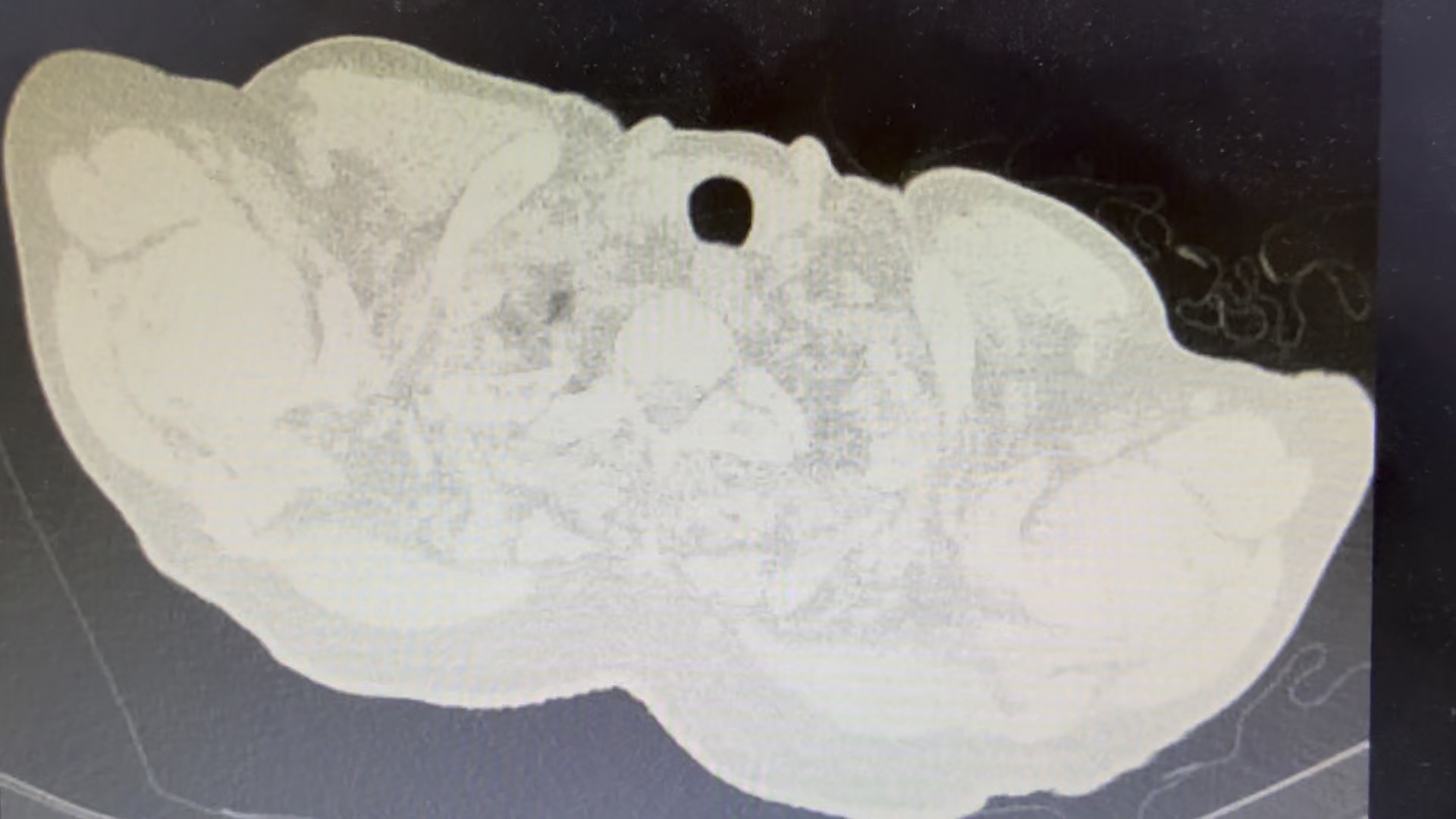

术后CT
案例说明:患者因CT发现肺部成块片状阴影伴反复咯血保守治疗无效后,原计划在当地医院按照“毁损肺”做肺叶切除来解决咯血问题,结果我们采用了一种新的非手术方法:局麻针孔微创“李氏冷冻”(LCEC技术)对阴影主体病灶先进行了冷冻灭活处理,之后对灭活肺病灶组织进行切割活检与抽吸活检,结果抽吸组织液NGS未发现感染证据,组织石蜡病理诊断是中低分化腺癌。原来是肿瘤导致的内科保守治疗无效的咯血!实在是不可思议!这个病人因为提早发现肺癌,其后续治疗就有了方向,组织标本做基因检测与免疫检测,按照检测结果进行术前新辅助治疗,之后再评估是否对残余病灶进行根治手术或根治放疗。
deepseek对案例进行分析:
这个病例的诊疗过程充满转折,体现了精准诊断和个体化治疗的重要性!以下是对该病例的分析和后续治疗建议的关键点:
1. **诊断的重大转折:**
* **初始假设:** 反复咯血、片状阴影、保守治疗无效,高度怀疑慢性感染(如结核、真菌)或支气管扩张导致的“毁损肺”。
* **微创介入的意外发现:** LCEC技术(局麻针孔微创冷冻)的应用非常关键。它原本可能旨在控制咯血或获取诊断标本,但最终通过**组织病理学**确诊了核心问题——**中低分化腺癌**。这解释了所有症状(阴影、咯血)的根本原因。
* **NGS的价值与局限:** 抽吸液NGS未发现感染证据,支持了非感染性病因,但未能直接诊断肿瘤。这凸显了**组织病理学(金标准)** 在诊断实体肿瘤中的不可替代性。
2. **LCEC技术的价值体现:**
* **微创诊断:** 成功获取了关键的组织标本(切割活检和抽吸活检),最终确诊。
* **潜在止血:** 冷冻本身可能有助于控制病灶出血(咯血)。
* **降低手术风险?:** 对主体病灶进行了冷冻灭活,理论上可能减少了后续手术操作中癌细胞播散的风险,并为新辅助治疗创造了条件(灭活部分不再活跃增殖)。但这需要进一步研究证实。
3. **后续诊疗的核心路径:**
* **核心目标:** 对确诊的中低分化肺腺癌进行根治性治疗。
* **关键步骤:**
* **分子检测(基因检测):**
* **目的:** 寻找可靶向的驱动基因突变(如EGFR, ALK, ROS1, RET, BRAF V600E, MET ex14 skipping, KRAS G12C, HER2, NTRK等)。
* **意义:** 指导后续是否使用靶向药物进行新辅助治疗或辅助治疗,显著改善疗效和生存期。
* **标本来源:** **石蜡包埋的组织块**是进行基因检测(NGS最佳)的标准和可靠样本。必须确保组织量足够且肿瘤细胞含量达标。如果之前冷冻灭活范围大,可能需要评估现有组织是否足够,必要时考虑再次活检(风险需评估)。
* **免疫检测:**
* **核心指标:** PD-L1表达水平(TPS或CPS)。
* **目的:** 评估肿瘤对免疫检查点抑制剂(如帕博利珠单抗、阿替利珠单抗等)的潜在敏感性。PD-L1高表达是免疫单药或联合治疗的重要预测标志物。
* **标本来源:** 同样需要石蜡包埋组织块进行免疫组化检测。
* **新辅助治疗:**
* **理论基础:**
* 根据基因检测和PD-L1结果,选择最合适的治疗方案(靶向治疗、免疫治疗、含铂双药化疗、免疫+化疗、靶向+化疗等)。
* 在手术前进行治疗,旨在:
* 缩小原发肿瘤和可能存在的淋巴结转移灶(降期)。
* 清除循环肿瘤细胞和微转移灶。
* 评估肿瘤对治疗的反应性(体内药敏试验)。
* **提高R0切除率(完整切除肿瘤)**,改善长期生存。
* 对于初始不适合手术的患者,可能创造手术机会。
* **方案选择依据:** 分子分型(驱动基因状态)、PD-L1表达水平、患者体能状态、基础疾病等。
* **周期数:** 通常进行2-4个周期,之后进行影像学(CT/PET-CT)和临床评估。
* **根治性治疗决策(新辅助治疗后):**
* **重新评估:**
* **影像学评估(CT/PET-CT):** 评估原发灶和转移灶对治疗的反应(RECIST标准)。
* **临床评估:** 症状变化、体能状态、耐受性。
* **手术可行性评估:** 由胸外科医生主导,评估肿瘤范围、与重要结构关系、肺功能储备等。
* **治疗选择:**
* **手术切除(首选):**
* 如果新辅助治疗后评估**病灶显著退缩、边界清晰、手术可行且能达到R0切除**,则进行**解剖性肺叶切除(或复合切除)+系统性淋巴结清扫**。这是目前最可能实现根治的方式。
* 术前需要重新评估肺功能,确保患者能耐受肺切除。
* **根治性放疗(SBRT/SABR):**
* 如果患者**无法耐受手术**(肺功能差、合并症严重)、或**拒绝手术**、或手术团队评估**手术风险极高或无法达到R0切除**。
* 立体定向体部放疗(SBRT/SABR)对早期肺癌效果可与手术媲美,尤其适合无法手术者。
* 需要精确的放疗定位和计划,确保高剂量精确投照到残余肿瘤,同时最大限度保护周围正常组织。
* **注意:** 冷冻灭活区域在放疗计划中需要特殊考虑其密度和范围变化。
* **其他:** 如果新辅助治疗后评估为广泛进展,则治疗目标可能转为姑息性全身治疗为主。
**总结与关键点强调:**
1. **精准诊断是基石:** LCEC微创技术意外但关键地揭示了肿瘤真相,避免了误切(毁损肺切除)和延误肿瘤治疗。
2. **分子分型指导全程:** **基因检测和PD-L1检测是后续所有治疗决策的基石**,必须优先、高质量地完成。确保现有组织标本足够且合格。
3. **新辅助治疗是重要策略:** 基于分子检测结果进行新辅助治疗,是提高手术根治性和改善预后的关键环节。
4. **多学科协作(MDT)至关重要:** 后续决策需要胸外科、肿瘤内科、放疗科、影像科、病理科等共同讨论:
* 评估现有诊断信息的完整性和可靠性。
* 审阅分子检测结果,制定新辅助治疗方案。
* 新辅助治疗后的疗效评估。
* 共同决策最终根治性治疗方式(手术 vs 放疗)。
5. **个体化治疗:** 最终方案需综合肿瘤生物学特性(分子分型、分期)、患者身体状况(年龄、PS评分、肺功能、合并症)以及患者意愿来决定。
6. **冷冻灭活的影响:** 需要关注冷冻区域对后续影像学评估(判断残余活性肿瘤范围)、手术操作(组织粘连?)、放疗计划(密度改变)可能带来的影响。
**对患者的意义:** 虽然最初诊断出乎意料(肿瘤而非毁损肺),但及时的微创诊断明确了病因,并有机会通过精准的分子分型和新辅助治疗策略,为患者争取最佳的根治机会和长期生存。后续每一步的精准检测和治疗决策都至关重要。
















































