蛋白凝胶电泳和WB常见问题和解决方案
蛋白凝胶电泳
1.蛋白条带无法分辨,泳道带有条纹且不直

可能原因
每条泳道上样的蛋白过多
解决方案
降低样品上样量。在带有10、12、15或17孔的小型胶中,获得理想分辨率的最大建议上样量是每条带0.5 ug ,或每条泳道约10—15 ug 细胞裂解液。
2.样品粘稠,在样品泳道边缘有条纹,哑铃型条带,泳道变宽
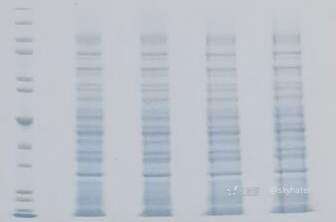
可能原因
凝胶电泳过程中,样品的盐浓度(硫酸铵)过高
解决方案
通过透析来降低盐浓度,在电泳前浓缩并用低盐缓冲液进行重悬,使用小体积浓缩管,确保盐浓度不超过100 mM 。
3.蛋白聚集导致了无法识别的狭窄泳道
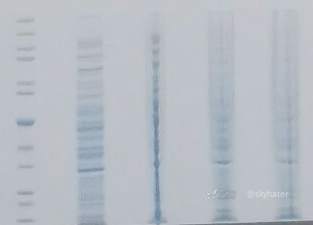
可能原因
DNA 污染—细胞裂解液中的基因组 DNA 可能会使样品变得粘稠,导致蛋白聚集,从而影响蛋白的迁移模式和分辨率
解决方案
在上样前剪切基因组 DNA 以降低样品的粘稠度。
4.样品泳道不均一,泳道变宽

可能原因&解决方案
一.凝胶电泳过程中样品盐浓度(氯化钠)过高。高盐浓度会导致电导率提高而影响蛋白的迁移,并使得蛋白条带延伸至相邻含有正常盐浓度样品的泳道中;
- 通过透析来降低盐浓度;
- 在电泳前进行浓缩并用低盐缓冲液进行重悬,使用小体积浓缩管;
- 确保盐浓度不超过100 mM ;
二.凝胶电泳中去垢剂(如SDS 或 Triton X -100去垢 Tween 20去垢剂)浓度过高。去垢剂与凝胶中的阴离子去垢剂SDS 可形成混合胶束,并向下迁移到凝胶中;它们会干扰 SDS —蛋白结合的平衡;
- 绝大多数非离子型去垢剂如 Triton X-100、NP-40和 SDS 或 Triton X-100去垢 Tween 20去垢剂)都会对 SDS-聚丙烯酰胺凝胶电泳( SDS-PAGE )产生干扰;
- 保持 SDS 和非离子型去垢剂的比例在10:1或更高以将这些影响降至最低;
- 使用去垢剂去除柱来去除多余的去垢剂;
三.高浓度的 RIPA 裂解液可导致电泳时泳道变宽并产生明显的条纹;
- 在电泳前将样品稀释以降低裂解缓冲液的终浓度,防止缓冲液相关问题发生。
5.泳道边缘有阴影
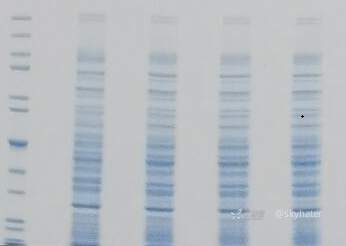
可能原因
裂解液或样品缓冲液中存在过量的还原剂
解决方案
用于 SDS-PAGE 的还原剂中, DTT (二硫苏糖醇)和CEP (三(2-羧乙基)膦)的终浓度应低于50 mM ,而βME ( β-—巯基乙醇)的浓度应低于2.5%。
化学发光免疫印迹
1.非特异性或弥散的条带
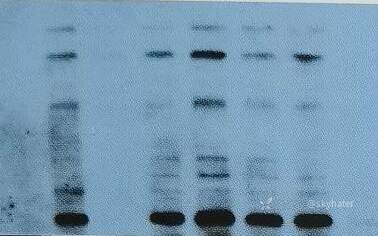
可能原因 解决方案
抗体浓度过高 降低抗体的浓度,尤其是一抗
上样至凝胶蛋白过多 降低凝胶中的蛋白上样量
来自化学发光底物信号过强 降低印迹膜曝光于胶片的时间
缩短膜与底物孵育的时间
在孵育后完全去除底物
降低抗体的浓度,尤其是 HRP 和 AP 标记抗体
2.仅部分区域显影或存在空白区域
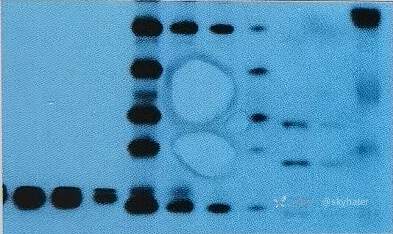
可能原因
转膜不完全
解决方案
- 通过在整个转膜三明治范围内使用气泡滚轮,来确保在转膜过程中凝胶和膜之间充分接触;
- 按照制造商的说明书进行膜的浸润和激活;
- 处理膜时始终佩戴洁净的手套或使用镊子。
3.高背景

可能原因&解决方案
一.抗体浓度过高
- 降低一抗或二抗的浓度
二.封闭液不适用
- 在亲和素-生物素体系中不要使用牛奶进行封闭,因为牛奶中含有生物素,可导致高背景;
- 当检测磷酸化蛋白时,应避免使用基于磷酸盐的缓冲液一如 PBS ,以及含有磷蛋白的封闭剂—如牛奶或酪蛋白,推荐使用溶于 Tris 缓冲液溶液中的 BSA ;
- 通过封闭一张洁净的膜、用抗体孵育并随后用相应底物进行检测,来测试封闭液的交叉反应性;
- 当使用碱性磷酸酶( AP )偶联物时,应选择溶于 Tris 缓冲液( TBS )的封闭液,因为磷酸盐缓冲液( PBS )会干扰 AP 的活性;
- 尝试另外一种与实验最具兼容性的封闭液。
三.非特异性位点封闭不充分
- 提高封闭液中的蛋白浓度;
- 优化封闭的时间和或温度。室温封闭至少1小时,或4C过夜;
- 向封闭液中加入 Tween 20去垢剂可帮助将背景降至最低。然而,过多的去垢剂会干扰抗体结合。0.05%的终浓度通常就能顺利发挥作用;
- 使用含0.05% Tween 20去垢剂的封闭液制备抗体稀释液;
- 使用"信号增强剂来降低背景,并增强低丰度蛋白和弱免疫反应性抗原的检测。
四.漂洗不充分
- 提高漂洗次数或所使用缓冲液的体积;
- 向漂洗液中加入 Tween 20去垢剂全终浓度0.05%。如果 Tween 20去垢剂的浓度过高,则会导致蛋白从膜上被剥离;
五.膜的处理不当
- 按照制造商说明书进行膜的浸润和活化;
- 处理膜时始终佩戴洁净的手套或使用镊子;
- 始终用液体覆盖膜以防止干燥;
- 在所有孵育过程中进行振荡;
- 小心处理膜—膜的损伤会引起非特异性结合。
六.设备或材料污染
- 使用前新鲜制备缓冲液,并对其进行过滤;
- 仅使用洁净且不含污染物的电泳设备、印迹设备和孵育托盘。
七.来自化学发光底物的信号过强
- 降低印迹膜曝光于胶片的时间;
- 缩短膜与底物孵育的时间;
- 在孵育后完全去除底物;
- 降低抗体的浓度,尤其是 HRP 和 AP 标记抗体。
4.信号较弱或无信号

可能原因&解决方案
一.转膜不完全或效率不高
- 转膜后,对凝胶进行染色以评估转膜的效率;
- 在转膜后,通过用 可逆转蛋白染色试剂盒对膜进行染色以评估转膜的效率;
- 通过在整个转膜三明治范围内使用气泡滚轮,来确保在转膜过程中凝胶和膜之间充分接触;
- 确保转膜三明治在转膜装置中的摆放方向正确,以便蛋白迁移至膜上
- 按照制造商说明书对膜进行浸润和激活
- 使用阳性对照(如预染分子量标准)评估转膜的效率;
- 使用与免疫印迹成像底物兼容的分子量标准免疫印迹蛋白标准品,作为阳性对照;
- 提高转膜的时间或电压;
- 确保样品制备条件不会破坏样品的抗原性。例如,某些蛋白不能在还原性条件下电泳。
二.与膜的结合不充分
- 对于低分子量( MW )抗原,向转膜缓冲液中加入20%甲醇以促进结合并防止蛋白穿透膜;
- 减少转膜时间,低分子量抗原可能会穿透膜;
- 对于高分子量抗原,向转膜缓冲液中加入0.01-0.05% SDS 以将蛋白从凝胶拉出至膜上;
- 更换膜的类型( NC vs . PVDF );
- 换成更小孔径的膜。
三.抗体浓度过低
- 抗体与目标蛋白的亲和性可能较低。提高抗体浓度;
- 抗体可能已经失去活性,可通过斑点印迹以检测效价。
四.抗原不足
- 上样更多蛋白样品至凝胶上。
五.抗原被封闭液掩盖
- 降低封闭液中蛋白的浓度;
- 查找与您的实验最具兼容性的封闭液。
六.缓冲液含有叠氮化钠
- 叠氮化钠会抑制 HRP 。请勿将其与 HRP 标记抗体一起使用。
七.来自化学发光底物的信号太弱
- 提高膜与底物孵育的时间;
- 提高胶片曝光的时间;
- 确保底物未过期或失效;
- 当蛋白样品量极少或样品高度稀释时,可使用极敏底物来获得更强的免疫印迹信号。
八.已剥离了印迹上的抗体并重新检测
- 避免在同一张膜上多次剥离抗体;
- 缩短在抗体剥离液中的孵育时间以防止抗原的损失。
九.膜上的抗原被消化
- 封闭底物可能具有蛋白酶活性(如明胶)。
十.印迹膜长时间保存,其上的蛋白降解
- 制备新的印迹膜。
看了赛默飞的蛋白免疫印迹优化指南感觉挺有用的,就发出来,让新手学习一下,后面还有免疫荧光可能遇到的一些问题,这个就弄了半天,休息休息
















































