CAR-T细胞治疗:系统性红斑狼疮的新希望?
前言
近年来,CAR-T细胞治疗系统性红斑狼疮成为热点话题。
然而,CAR-T细胞治疗真的是答案吗?
什么是CAR-T细胞治疗?
CAR是英文Management of chimeric antigen receptor的缩写,中文习惯翻译为:嵌合抗原受体。
CAR是模块化合成细胞受体,具有四个主要区域:单链可变片段(ScFv)和铰链区,这两个负责细胞外抗原识别结构域;跨膜结构域(TMD);一个细胞内激活结构域[1]。
利用生物工程技术改造T细胞,让T细胞有CAR,即CAR-T细胞。
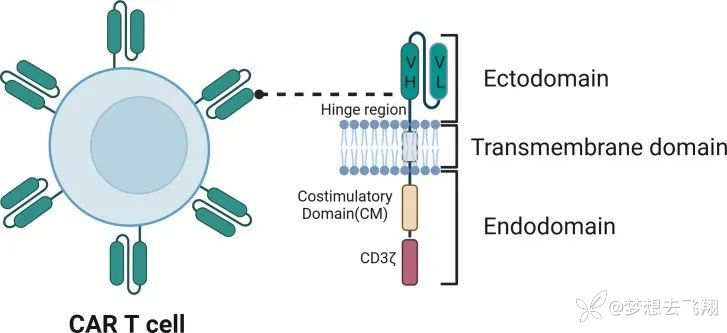
图1. CAR-T细胞(左)及CAR结构(右)示意图[2]
对图1的解释
CAR包含一个细胞外域,通常是来自抗体的scFv,包括一个可变重链区(VH)和一个可变轻链区(VL),负责识别抗原。跨膜结构域(TMD)将CAR锚定在T细胞膜上。内结构域包括信号元件,例如包含ITAM的CD3ζ链,以及增强T细胞活化、增殖和持久性的共刺激结构域(CM)。
scFv是最常用的配体结合结构域。scFvs的功能取决于它们的亲和力、亲和力、聚集性和灵活性。scFv亲和力的调节是提高CARs特异性同时最大限度地减少肿瘤外细胞毒性副作用的关键因素[3]。
自1989年CAR首次开发以来,基于对CAR细胞内结构域的工程改造,CAR-T细胞可分为五个不同的世代。值得注意的是,新一代的进展并不意味着既往版本的过时,而是扩大了不同治疗需求的可用选择。
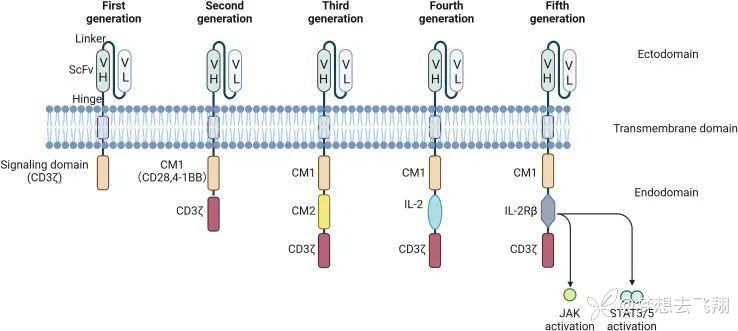
注:IL:白细胞介素;CD:分化簇;NFAT:活化T细胞的核因子;ITAM:基于免疫受体酪氨酸的激活单元
图2. 基于细胞内结构域的改造差异,CAR-T细胞分为5代[2]
对图2的解读
第一代CAR的特征是只有一个源自CD3ζ的信号转导结构域。
第二代CAR还额外包含一个共刺激结构域(CM1),例如CD28或4-1-BB。
在第二代CAR的基础上,第三代CAR包含第二个共刺激结构域(CM2)。
第四代CAR-T细胞,也称为通用细胞因子介导的杀伤(TRUCK)重定向的T细胞,含有NFAT转录元件,可在肿瘤微环境中诱导特定趋化因子(如IL-12)的表达。
第五代CAR是通用的CAR-T细胞。
实际上,随着技术进步,也开始不仅仅是改造T细胞,还扩展到其他细胞。比如,Tregs、NK细胞和巨噬细胞(M细胞)。
无论是对CAR-T细胞,还是其他CAR改造过的细胞,其治疗都有各自的优缺点。本篇不展开讨论。
CAR-T细胞治疗的大体流程
目前主流的CAR-T细胞治疗的操作流程如下[4]:
1,首先,通过大容量静脉通路从病人血液里单采淋巴细胞。
2,利用病毒(例如逆转录病毒)或非病毒(例如转座子系统)载体将CAR编码基因引入T细胞,从而形成CAR-T细胞。
3,CAR-T细胞的体外扩增。
4,几周后进行CAR-T细胞的输注。
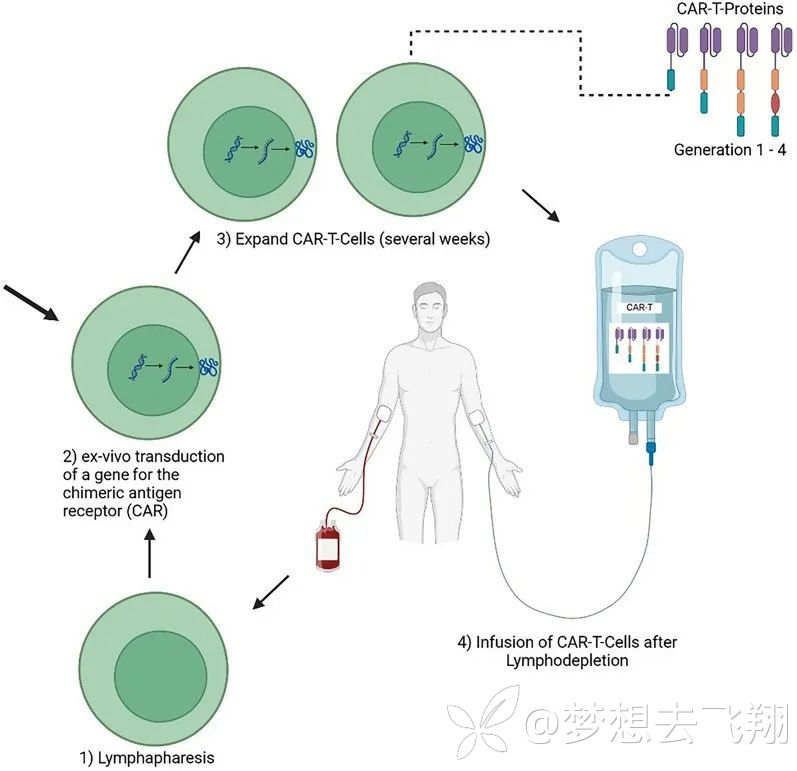
图3. CAR-T细胞治疗的操作流程[4]
请注意,有些CAR-T细胞治疗时,并没有选择病人自身的淋巴细胞做改造,而是选择预先采集的其他人的血淋巴细胞,即通用淋巴细胞。或者采用多能“干细胞”做改造。
还需注意的是,CAR-T细胞输入前3-5天会采取“淋巴细胞清除化疗(LD)”。LD治疗时需确保仔细监测和适当补液[5]。
基于氟达拉滨-环磷酰胺的方案是使用最广泛的LD方法主要目的是通过调节细胞因子和免疫途径来允许稳态CAR-T细胞在体内扩增和存活,其目的有两个[6-7]:
- 减少内源性淋巴细胞和炎症负荷,以防止CAR-T细胞的快速耗竭;
- 为CAR-T细胞的最佳植入、归巢和CAR-T的长期存活准备“生态位”。
48小时后,CAR-T细胞解冻并立即静脉输注到患者体内[6-7]。
CAR-T细胞如何治疗红斑狼疮?
CAR-T细胞治疗的优势是可以直接识别肿瘤相关抗原(TAA),而无需主要组织相容性复合体(MHC)介导的抗原呈递[8-9]。
那么在治疗系统性红斑狼疮(SLE)时,它是如何发挥作用的?
实际上,CAR-T细胞治疗是针对SLE病人B细胞的靶向治疗。
B细胞的发育始于骨髓中的祖细胞B细胞,然后经历一系列增殖和分化步骤,将早期pro B细胞(CD19+/CD22+)转化为前B细胞(CD19+/CD20+/CD22+/CD40+/CD79b+)[10]。
在骨髓中进一步分化为未成熟的B细胞(CD19+/CD20+/CD22+/CD40+/CD79b+/BAFFR+)后,这些细胞经历抗原受体基因重排,在分化的后续阶段在其表面产生独特的B细胞受体(BCR)。
BCR促进未成熟B细胞与抗原的特异性结合,触发其活化以及随后的增殖和分化。随后,活化的B细胞迁移到淋巴结或其他次级淋巴组织进行亲和成熟。在这个过程中,与抗原结合的高亲和力B细胞有利于存活和分化为成熟B细胞(CD19+/CD20+/CD22+/CD40+/CD79b+/BAFFR+/TACI+)。
最终,出现表达表面免疫球蛋白(Ig)并具有产生抗体的能力的成熟B细胞。
根据免疫反应的性质,这些成熟的B细胞可以分化成各种细胞类型,包括[11]:
- 记忆B细胞(CD19+/CD20+/CD22+/BCMA+/CD38+/BAFFR+/CD40+/TACI+);
- 短寿命浆母细胞(CD19+/BCMA+/CD38+/BAFFR+/CD40+/TACI+);
- 长寿命浆细胞(BCMA+/CD38+/CD138+/BAFFR+/CD40+/TACI+)。
分化后,B细胞表达独特的表面分子,这些分子可作为B细胞介导的疾病(如SLE)的潜在治疗靶标。
目前主要的B细胞标靶有:
- 从pro-B细胞到浆母细胞的多个B细胞发育阶段中都表达CD19,浆细胞除外。
- 从前B细胞阶段到记忆B细胞都表达CD20和CD22,但在浆母细胞和浆细胞中不存在。
- 浆细胞广泛表达其他B细胞受体,包括BCMA、CD38和CD138。
- BCMA和CD38也在浆母细胞和浆细胞中表达。
到目前为止,CD19是CAR-T细胞疗法中B细胞耗竭的关键靶标。这是因为它除浆细胞外的其他B细胞系都广泛存在。因此,针对CD19是最能耗竭B细胞的选择。
针对SLE的CAR-T细胞疗法试验里,几乎都把标靶选择为CD19,或CD19联合其他标靶;目前只有上海仁济医院的一项临床试验(NCT06249438)里试用C-CAR168,其标靶是CD20/BCMA,而没有选择CD19[12]。
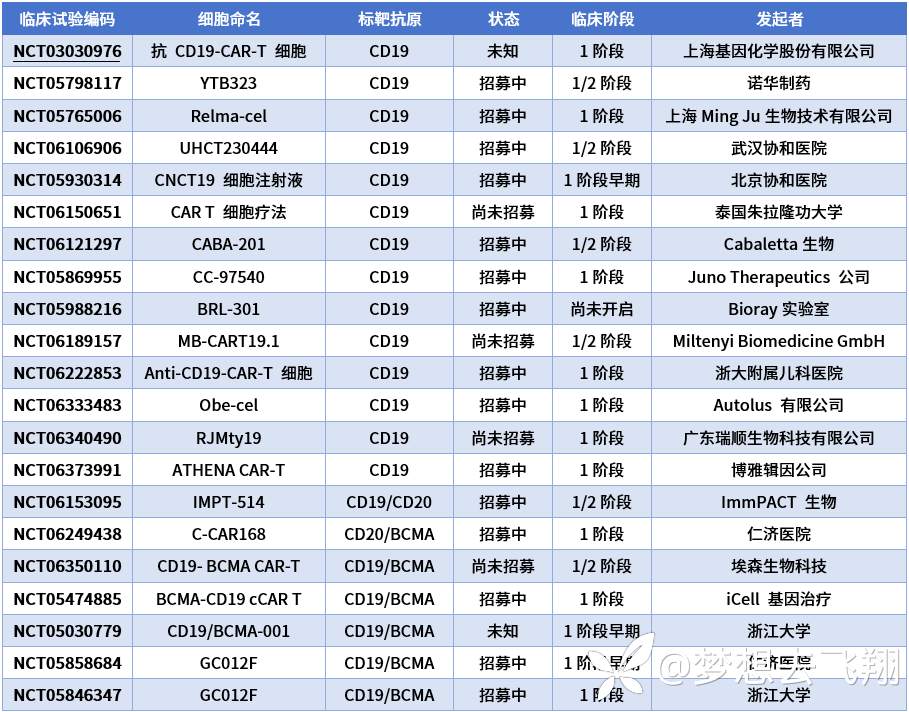
表1. CAR-T治疗研究汇总[12]
从上可知,CAR-T细胞治疗的本质就是靶向性的清除SLE病人的B细胞。目前已有的B细胞清除治疗可能不够强。(比如,利妥昔单抗等药物)
CAR-T细胞治疗时,其作用机制是直接细胞间接触,从而启动细胞毒性作用。这样可能导致更强大和持续的反应。
比如,有研究认为它不只是清除血液循环里的B细胞,还可以消除组织驻留的B细胞——侵入皮肤、肾脏甚至骨髓和淋巴结等组织,从而更深更彻底的清除B细胞[13]。
然而,CAR-T细胞治疗的疗效如何,副反应几许?它会成为SLE治疗的答案吗?
后续讨论CAR-T细胞治疗的疗效与副反应。
下期预告:
《CAR-T细胞治疗红斑狼疮的利与弊》
参考文献(上下滑动查看):
[1] Sadelain M., Brentjens R., Riviere I. The basic principles of chimeric antigen receptor (CAR) design. Cancer Discov. 2013;3:388–398.
[2] Yaojie Kong , Jingyao Li , Xueyao Zhao , Yanwei Wu , Liang Chen . CAR-T cell therapy: developments, challenges and expanded applications from cancer to autoimmunity . Front Immunol. 2025 Jan 9;15:1519671.
[3] Jayaraman J., Mellody M.P., Hou A.J., Desai R.P., Fung A.W., Pham A.H.T., Chen Y.Y., Zhao W. CAR-T design: Elements and their synergistic function. EBioMedicine. 2020;58:102931.
[4] Schroeder T, Martens T, Fransecky L, Valerius T, Schub N, Pott C, Baldus C, Stölzel F. Management of chimeric antigen receptor T (CAR-T) cell-associated toxicities . Intensive Care Med. 2024 Sep;50(9):1459-1469. doi: 10.1007/s00134-024-07576-4. Epub 2024 Aug 22.
[5] R. Greco, T. Alexander, N. Del Papa, F. Müller, R. Saccardi, F. Sanchez-Guijo, et al. Innovative cellular therapies for autoimmune diseases: expert-based position statement and clinical practice recommendations from the EBMT practice harmonization and guidelines committee .EClinicalMedicine, 69 (2024), Article 102476, 10.1016/j.eclinm.2024.102476
[6] S. Kretschmann, S. Völkl, H. Reimann, G. Krönke, G. Schett, S. Achenbach, et al.Successful generation of CD19 chimeric antigen receptor T cells from patients with advanced systemic lupus erythematosus .Transplant Cell Ther, 29 (2023), pp. 27-33, 10.1016/j.jtct.2022.10.004
[7] S.I. Van Leuven, R. Duivenvoorden .CAR-T cell therapy in systemic lupus erythematosus and beyond: a brave new world? Rheumatology (2024), 10.1093/rheumatology/keae108
[8] Maalej KM, Merhi M, Inchakalody VP, Mestiri S, Alam M, Maccalli C, et al. CAR-cell therapy in the era of solid tumor treatment: current challenges and emerging therapeutic advances. Mol Cancer. (2023) 22:20. doi: 10.1186/s12943-023-01723-z
[9] Benmebarek MR, Karches CH, Cadilha BL, Lesch S, Endres S, Kobold S. Killing Mechanisms of Chimeric Antigen Receptor (CAR) T Cells. Int J Mol Sci. (2019) 20. doi: 10.3390/ijms20061283
[10] Arbitman L, Furie R, Vashistha H. B cell-targeted therapies in systemic lupus erythematosus. J Autoimmun. (2022) 132:102873. doi: 10.1016/j.jaut.2022.102873,
[11] Elsner RA, Shlomchik MJ. Germinal Center and Extrafollicular B Cell Responses in Vaccination, Immunity, and Autoimmunity. Immunity. (2020) 53:1136–50. doi: 10.1016/j.immuni.2020.11.006
[12] Jincai Zhou , Bixia Lei , Feifei Shi , Xinran Luo , Kai Wu , Yanhong Xu , Yuting Zhang , Rongjiao Liu , Huajing Wang , Joy Zhou , Xiaowen He . CAR T-cell therapy for systemic lupus erythematosus: current status and future perspectives . Front Immunol. 2024 Dec 19;15:1476859.
[13] Alsuliman T, Marjanovic Z, Rimar D, Tarte K, Avcin T, Hagen M, Schett G, Farge D. Harnessing the potential of CAR-T cell in lupus treatment: From theory to practice . Pediatr Rheumatol Online J. 2024 Aug 8;22(1):72. doi: 10.1186/s12969-024-00990-4.















































