为什么多家氟比洛芬酯注射液未被批准?化药3类到底要不要做验证性临床?
人生没有白走的路 每一步都算数。学习就是一个日积月累的过程,不积小流,无以成江海,每日学习一点点,未来必定会得到想要的答案,今日给大家分享一篇关于临床的文章,觉得文章不错记得给个小心心哦 ~
~
截止目前已经有包括扬子江、西安立邦、山东威高、本溪恒康、四川科伦、广东嘉博等几个厂家按照3类申报生产的氟比洛芬酯注射液未被批准,还有重庆药友正在审评、宜昌人福正在进行BE、南京优科正在进行安全性有效性的验证性临床。那么重庆药友、宜昌人福和南京优科的最终结局如何呢?希望本文能为化药3类开发带来一些参考意义。
为什么多家氟比洛芬酯注射液未被批准?化药3类到底要不要做验证性临床?
为什么多家氟比洛芬酯注射液未被批准?化药3类到底要不要做验证性临床?
一、化药3类的临床到底该如何做
这个问题,本文将从药物开发的基本原理、科学基础以及ICH主要成员国的国际惯例方面来讲解,而不是从指导原则方面讲解,因为原理、科学和常识是指导原则制定的基础,当我们掌握的是指导原则制定背后的逻辑时,无需看指导原则也知道试验该如何进行。目前的化药3类,每个品种的情况可能不一样,需要具体品种具体分析,指导原则无法覆盖所有情况,如果未掌握这些底层逻辑研究策略可能会出现较大偏差。
(1)药物的三个基本要素:安全、有效和质量可控。药物研发是一道证明题,我们需要向监管部门提交能够证明这3个基本要素的研究资料,按照目前ICH M4申报资料的组织形式,对应的资料分别是模块3(质量可控,Q)、模块4(安全性,S)、模块5(有效性,E)。
(2)药品说明书中经常提到的安全性有效性针对的是人体,通常是在人体临床试验中取得的,一般有效性作为主要终点,安全性作为次要终点,注意不要和模块4的安全性(S)搞混了,之前看到过一些厂家的参比制剂备案资料,在安全性有效性方面错误的提交了非临床安全性的资料,实际上应该提交的是人体的安全性,即通常为人体临床试验研究中的不良事件情况/不良反应情况。
(3)具有充分或完整安全性有效性数据是药物上市的必备条件之一。完整安全性有效性数据通常是境内/域内第1个上市厂家取得的,后续厂家可以直参考境内/域内已有的完整安全性有效性数据申请上市,例如FDA的ANDA申请,参考的手段就是进行BE研究(或者申请豁免BE),这也是仿制药以及一些改良型新药开发的理论基础和国际惯例。当然,后续仿制药厂家是否有重新进行完整安全性有效性数据研究的情况呢?从研发成本的角度来看,很少有厂家会这么干,一般成熟监管部门也不会批准这样的临床试验,因为这是违背伦理原则的,不能让过多的受试者无畏暴露于试验药物之下。此外,安全性有效性数据是有人种属性的,不能用境外人种的数据来支持境内的上市,除非可证明无人种差异。
(4)BE是一种桥接试验,字面意思就是在参比制剂和受试制剂间建立一做桥梁,将两种制剂的安全性有效性连接起来。实际上就是受试制剂桥接了参比制剂的安全性有效性,生物等效的两种药物,安全性有效性是相似的,仿制药的说明书也需要和参比制剂一致。BE研究只是起到桥接作用,不能获得安全性有效性数据。
(5)国内创造性的将未在境内上市药物指定为参比制剂是造成目前3类化药研究较复杂的根源。ICH主要成员国的参比制剂,均为境内/域内上市的药物,这些国家的仿制药上市通常只需进行BE即可(或者申请豁免BE),对应的情况是国内的4类仿制药。目前国内的3类,在ICH主要成员国是按照新药进行管理的。对于国内的3类,同样也把很多老外搞蒙了。
(6)3类按照仿制药管理,提交上市申请时需要考虑三方面问题:①是否与参比制剂生物等效,需要进行的是BE研究(或申请豁免BE)。②申报产品国内人群安全性有效性数据是否完整,不完整需要进行验证性临床。③最重要的一点,也是最容易被忽略的一点,如果与境外上市的参比制剂(境内未上市或在国内寻踪不到任何安全性有效性)进行BE,只是桥接了境外的安全性有效性,在境外的参比制剂上市国家申请上市没有问题,但是如果想在境内申请上市,还需要评估境外参比制剂的安全性有效性和境内安全性有效性情况的差异。至于如何评估差异,限于篇幅有限,不在这里展开了。3类仿制药药品说明书的适应症和用法用量需要按照境内说明书起草,否则临床上同一通用名的药品将造成用药混乱。
(7)实际上,CDE在2020年底29号发布的《境外已上市境内未上市药品临床技术要求》中已经总结了3类该如何进行临床研究,如果能够理解以上介绍的这些理论、常识和国际惯例等,对于下面决策树(摘自药闻天下)的理解是非常容易的。

(8)目前上市申请的最终审评结果有两种,①符合上市条件,批准上市;②不符合上市条件,不批准上市,目前的这两种结果,才是正常的逻辑。前些年的上市申请,发临床批件的情况一去不复返了,从逻辑上也是说不通的。这也和监管职能的转变有关,CDE是负责审评的,不是负责给出临床试验方案的,采取什么样的临床研究策略是申请人的事情,这也对不只做仿制药的企业提出了更高的要求,企业需要有懂临床+药学底层逻辑的人或团队来把握研究方向。
(9)以上是基于科学及常识来判断3类仿制药到底该怎么做,也不排除一些其他非科学因素的干扰,当然这种情况毕竟是少数,随着时代的发展,相信这种例外的情况会越来越少。
二、 氟比洛芬酯注射液的研究策略
(1)产品基本信息
氟比洛芬酯注射液国内最早于2004年上市,生产厂家北京泰德制药股份有限公司,批准文号国药准字H20041508,距今已上市近20年了,市场销售峰值约30亿,确实是一个非常大的品种,难怪这么多的企业仿制,该产品已在国内应用多年,已有完整的安全性有效性数据。北京泰德制药的产品信息大概如下:
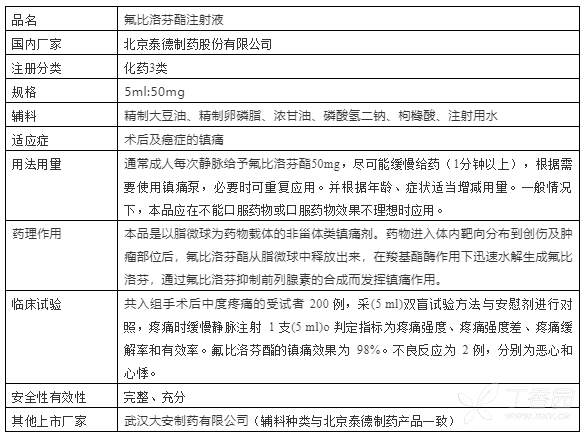
该产品是一种微球制剂,为特殊注射液,做成微球的原因也是为解决常规注射液半衰期短的问题,提高了给药的依从性。目前国内这个两个厂家的产品均已进入中国上市药品目录集,均通过或视同通过一致性评价。
(2)参比制剂
①氟比洛芬酯注射液参比制剂第21批公布,参比制剂编号21-42,为日本上市的原研产品,商品名Ropion,规格5ml:50mg,未进口到国内。
②另外,在中国上市药品目录集中,已经指定了北京泰德制药的产品为参比制剂,如下图所示:
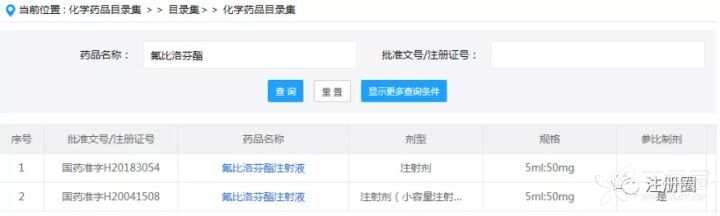
两个参比制剂关键信息对比如下:
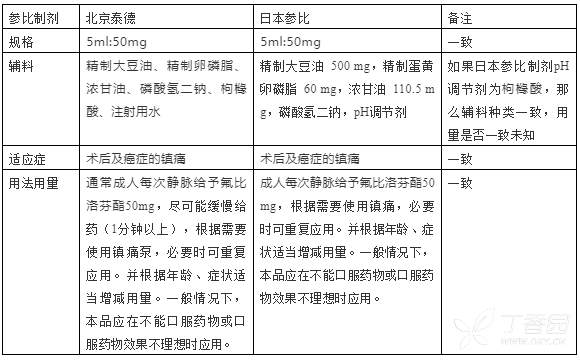
也就是说,本品目前有两个参比制剂,一个是日本上市原研产品,另一个是北京泰德制药的产品。从国内人群安全性有效性角度、以及目前参比制剂的遴选原则来说,应首选国内上市参比制剂,即本品的开发应该选择国内上市北京泰德制药的产品作为参比制剂。
(3)开发策略
制定本品的开发策略应明确几点:
①本品在国内已有完整的安全性有效性数据,如果直接进行桥接,无需再开展验证性临床;
②本品为特殊注射剂,无法豁免BE,需要进行BE研究;
③BE研究的前提是需要与参比制剂的辅料满足定性定量相似的要求,即FDA通常指的Q1/Q2。
基于以上情况,可以有以下几种研究策略

实际上目前不批准的和正在进行BE的厂家,基本采用了第3个研究策略,只和日本参比制剂进行BE是不能满足国内上市条件的(去日本申请上市是满足要求的),同时也违背了国内参比制剂的遴选原则,在进行药学及临床对比研究时也需要首选国内上市的参比制剂。个人认为,在第3个研究策略的基础上,BE研究时增加1个国内参比制剂,进行3交叉研究,受试制剂分别与日本、国内参比等效的情况下,可以满足国内上市条件(如果两个参比制剂辅料种类及用量有显著差异,需评估差异对安全性有效性的影响)。
南京优科采用了第4个研究策略,取得预期研究结果情况下,满足国内上市条件,但投入研究成本较高。
此外,还有1个产品格隆溴铵注射液比较典型,恒瑞2020-09-28获得生产批件,广东一家企业在2020-10-10按3类申报生产,也就是在恒瑞拿到生产批件没几天就申报了,审批结果为不批准。实际上,恒瑞的产品批准上市那一刻,格隆溴铵注射液国内人群的安全性有效性即被确立,后面的企业应该桥接恒瑞的产品才有可能豁免BE或豁免验证性临床,也就是说不能仅仅和国外的参比做对比研究,还需要将国内上市产品作为对照药开展对比研究,具体研究策略如何,这里就不再展开了。还有,无论哪个产品,药品说明书写的有问题,也有可能成为不批准的原因,尤其是适应症和用法用量,因为这两项是直接与安全性有效性挂钩的。
免责声明:编辑对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。仅作参考,并请各位自行承担全部责任。本文转载仅为交流学习,版权归原作者所有。如遇版权问题请版主删除。(来源于:注册圈)















































