化药CMC研发质量管理体系创建要点
药品全生命周期管理理念已经得到国内外主流监管机构的一致认同,现行药品管理法已经明确MAH对药品全生命周期质量负责。不同于药品生产有GMP规范、非临床研究GLP、临床试验GCP、药物警戒GVP,药品药学研究(CMC)并无明确的管理规范,不同阶段CMC的性质,决定了其质量管理体系应该具有灵活性和科学性, ICHQ10药品质量体系,涵盖了药品研发质量体系的概述说明,但是针对不同规模、组织架构的公司,药品研发质量体系组成和呈现形式,可以不同,作者有幸负责公司化药CMC研发质量体系创建,以下主要依据对CMC研究国内外法规指南要求的理解,结合实际工作经验,对化药CMC研发质量体系创建要点进行说明:
1.化药CMC研发质量管理体系构成
根据CMC研究所涉及的工作,化药CMC质量体系可以拆解含项目管理(或可设立专门项目管理部负责)、研发活动(主要含原料药合成、制剂研究,以及涉及的人员、物料、产品管理等)、质量控制(检验分析、方法开发和验证、稳定性、文件记录、变更、偏差、留样等)、文档管理(记录、台账、报告等,需满足数据完整性要求)、仪器和设备(校验、确认、验证等,尤其是计算机化系统验证)等。对于有生产体系的公司,厂房、设施、公用系统等一般共用公司GMP体系,对于纯研发的企业,则需要建立相应的厂房、设施、公用系统等体系,可参照GMP的相关规定执行。
2.质量管理体系创建要点
2.1 项目管理
高效、科学的项目管理,是药品研发的关键,根据企业的不同特点,可以将商务洽谈、立项等纳入前期准备阶段,成立项目组,制定项目计划(动态调整),在项目实施过程中对节点尤其是关键节点进行控制(比如路线探索完成、中试放大、工艺转移、工艺验证、分析方法开发、分析方法验证、CTD申报等),并对阶段性成果交付进行审评,当项目完成所有要求的模块内容、通过审评后,可以对项目知识成果进行归档(纸质和电子),完成项目结题,最后根据项目贡献度和完成质量,进行项目奖励分配和发放,项目管理的参考流程如下:
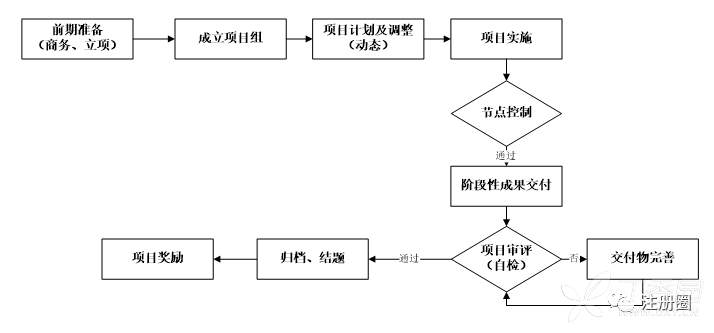
图1化药CMC研究项目管理流程
2.2 研发活动
参照GMP对药品生产的管理,可将合成工艺和制剂工艺研究(含中试放大)等活动纳入研发活动,并涵盖涉及的人员、物料、产品管理等工作。1)工艺研究原料药和制剂工艺研发,主要涉及处方、工艺研究、中试放大等工作,到技术转移阶段即可完成向车间生产线的工艺交接,需要遵守GMP,以上市注册申报为例,列举CMC研究一般流程及对应主要参考指南如下:
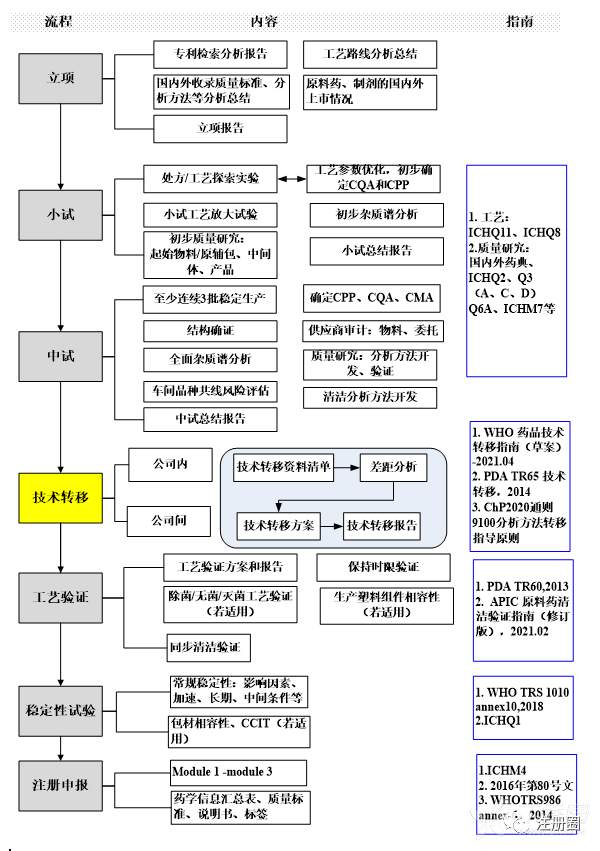
图 2 化药上市注册CMC研究一般流程
2)人员主要涉及人员的岗位说明、再教育、培训等管理。3)物料主要含物料的申请、采购、领用、验收、放行等,研发前期物料一般可仅凭厂家COA放行,随着研究深入可以逐步完善物料质量控制方法,完成至少对鉴别项的检查。4)产品研发阶段获得的产品,可用于多种用途,如分析方法开发和验证、工艺优化对比、初步稳定性考察等,因此应从整体的研究策略考虑,对产品进行管理。
2.3 质量控制
质量控制工作一般可包括:检验分析、方法开发和验证、质量对比研究、稳定性、记录、变更、偏差、留样等工作,同样含对人员(岗位说明、培训等)、样品(取样、接收、分发、销毁等)等的管理。尤其注意研发阶段的变更和偏差管理尺度,建议与GMP要求应有所区别,比如研发阶段工艺、分析方法等,偏离正常设定的参数、结果时,可通过在试验记录和报告中进行描述,比如可在试验记录末尾,设定“异常说明项”,对过程中涉及的偏差、变更情况进行描述,对后续解决措施进行说明,在方案和/或报告中可设定“变更历史”模块,对涉及的变更、偏差情况及关联工作完成情况进行描述,经主管领导审核、确认,最终完成闭环,研发阶段应侧重关注科学性、可追溯性,减少非必要的文件和流程管理,提高研发效率。
2.4 文档管理
文档主要含记录、台账、方案、报告类等资料,是监管机构现场检查的重点内容,方案和报告类需要关注科学性和技术符合性,可主要参考ICHQ系列指南和国内药品研发的相关指导原则。记录、台账等需要满足数据完整性,目前WHO、PIC/S、EMA和国内药监局,均出台了关于数据完整性的指南,国外较国内更加细化,可操作性强,可重点参考“WHO技术报告1033,附录4数据完整性指南(2021)”和“PDA TR80实验室数据完整性管理(2018)”,制定适合内部的良好文档管理。
2.5 仪器、设备
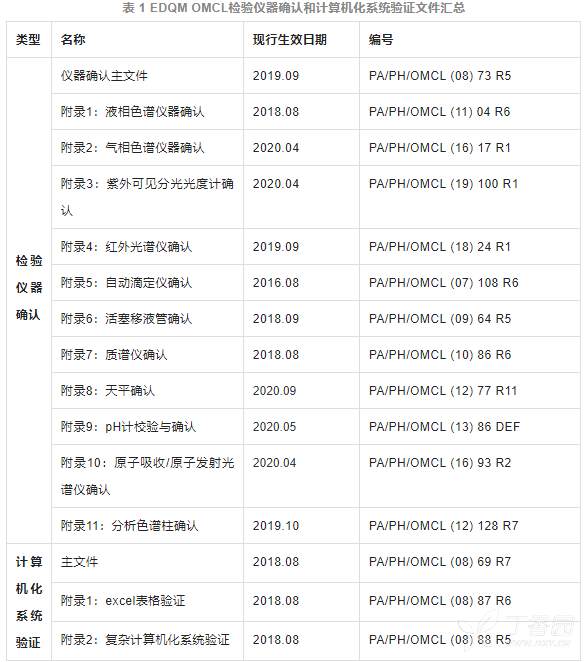
含研发工艺研究和质量研究所需要的仪器、设备,应当建立CMC研发用所有仪器、设备清单,并定期完成校验、确认,保存相应的记录、台账、报告等。尤其重点关注质量控制用分析仪器的管理,此为监管机构现场检查的关键项之一,可参考EDQM官方药品控制实验室(OMCL)对检验仪器确认和计算机化系统验证规范文件(见下表1),建立和完善内部体现文件。
表 1 EDQM OMCL检验仪器确认和计算机化系统验证文件汇总
小结
随着全生命周期质量管理的监管理念推进实施,建立科学、完善的药品研发质量管理体系可以有力助推药品注册上市的进程,笔者主要结合个人在研发质量体系创建中的一些思路和经验,概述了化药CMC质量体系创建的要点,希望对同行有一点启发,不足之处,欢迎批评指正。