线粒体相关研究文献分享,轻松读完一篇文献(一)
今天分享一篇发表在Talanta(2020年IF=5.339)上的文章,名为《Rapid and quantitative in vitro analysis of mitochondrial fusion and its interplay with apoptosis》[1]( 线粒体融合及其与凋亡的相互作用的快速和定量体外分析)。

线粒体是高度动态的细胞器,不断地进行融合和分裂。线粒体融合除了通过内容物混合维持基因组的稳定性和生理功能,还与细胞凋亡、代谢和自噬有关。线粒体融合缺陷与许多人类疾病有关,如神经退行性疾病、心血管疾病和癌症。由于线粒体融合缺失导致细胞线粒体网络碎片化,研究线粒体融合最经典的方法是基于线粒体形态学的微观分析。然而,线粒体碎片可能是融合减少或裂变增加的结果,线粒体融合水平不能直接测量。由于线粒体融合和裂变协同调控线粒体形态和功能,线粒体融合在细胞凋亡和癌症进展中的直接作用仍不清楚。因此,对线粒体融合的直接定量测量是研究其在细胞过程和疾病发病机制中的重要作用以及筛选其调控因子的迫切需要。
线粒体分裂需要将细胞质Drp1(一种裂变必需的动力相关蛋白)募集到线粒体,并与内质网结合。与线粒体分裂不同,线粒体融合不依赖于细胞质蛋白,可以通过线粒体膜内嵌的GTPases来促进。2004年首次报道了线粒体融合的体外研究,通过荧光显微镜展示其能量需求和分子水平促进线粒体融合的过程。研究表明,体外融合实验可以真实再现体内线粒体融合。通过将线粒体与细胞质等亚细胞细胞器分离,可以最大限度地减少裂变等因素的干扰,使数据解释更加直观。此外,体外线粒体融合实验还可以揭示线粒体的内在异质性。线粒体融合的体外分析不仅为了解融合GTPases在调节线粒体附着和外膜(OM)、内膜(IM)融合中的特定作用提供了重要的视角,而且促进了融合调节因子的发现。荧光显微镜和电子显微镜(EM)是线粒体融合体外分析最常用的方法,但显微技术是劳动密集型和半定量的,在高通量筛选融合调节剂方面效率低下。
为了实现鞘流中单分子荧光检测的策略,我们开发了纳米流式检测技术(nFCM),它在侧向散射和荧光检测方面的灵敏度比传统流式细胞术高出数百倍。利用实验室构建的纳米流式细胞仪(nFCM)在单个线粒体多参数分析方面的卓越灵敏性,我们报道了一种高通量和定量的体外线粒体融合测量方法。将分离的表达绿色荧光蛋白(GFP-mito)和dissoma红色荧光蛋白(DsRed-mito)的线粒体混合,诱导融合,并用nFCM分析。同时出现绿色和红色荧光信号的颗粒被确定为异型融合颗粒。为了更好地理解线粒体融合和细胞凋亡之间的相互作用,本研究采用已开发的方法,研究胞质凋亡通路对线粒体融合的影响,研究融合在细胞凋亡中的直接作用,并确定可以直接调节线粒体融合的化合物。
研究过程:
一、材料(略)
二、 细胞培养和稳定转染
HeLa细胞在含有10%胎牛血清的DMEM中培养。转染前12-24小时,将HeLa细胞置于12孔培养皿中,每孔2×10^5个细胞。来自Aequorea coerulescens和dissoma sp. red荧光蛋白(DsRed)的人源化GFP分别编码为pAcGFP1-Mito和pDsRed2-Mito,这两种蛋白均含有人细胞色素c氧化酶亚基VIII (Mito)的线粒体靶向序列。使用TransLipid HL转染试剂将编码GFP1-Mito或DsRed2-Mito的质粒分别转染到HeLa细胞中。两种质粒表达48 h后,加入250 ~ 500 μg/mL G418,3 ~ 4周筛选稳定表达的细胞。稳定转染的细胞群被扩增,并按照标准方案存储。
三、 线粒体和胞浆提取物的分离
每次实验,未转染HeLa细胞或稳定表达线粒体靶向荧光蛋白(GFP或DsRed)的细胞在15cm板中培养至90%的融合度。为了制备凋亡细胞液,将未转染的细胞分别在含有250nM staurosporine的培养基中培养3和9 h。用胰蛋白酶法收集细胞,并用PBS洗涤。细胞颗粒在800 μL冷线粒体分离试剂A中重悬,用Dounce组织研磨机在冰上研磨60次得到细胞匀浆。将匀浆转移到一个新管中,加入800 μL冷线粒体分离试剂C并混合。匀浆4度700 g离心10分钟去除细胞核和完整的细胞,上清重复一次4度700 g离心10分钟。将上清液转移到一个新的试管中,12,000 g4度离心15分钟。上清部分为胞浆富集部分。用BCA法测定线粒体和富细胞质组分的蛋白浓度。将提取物分装,在液氮中瞬间冷冻,冻干,并在−80度下保存备用。
四、 线粒体体外融合
将含有160 μg总蛋白的分离线粒体混合物用100 μL FB-A重悬,4度16000 g离心浓缩10 min。在去除上清液之前,将浓缩的线粒体颗粒放在冰上孵育至少10分钟。然后在40 μL FB-B (OM和IM融合过程)或FB-A (OM融合过程)中重悬,第二级融合在37度下进行90分钟。
五、胞质提取物及化合物对线粒体融合的影响分析
为了分析不同细胞质提取物对线粒体融合的影响,分别在第1阶段(离心前添加5 min,第1阶段保持)和第2阶段,将分离的线粒体重悬在FB-A和FB-B制备的5mg/mL细胞质提取物中。为了分析不同化合物对体外线粒体融合的影响,在第1阶段(离心前添加5分钟,并在第1阶段保持)和第2阶段(在FB-B重悬时添加),分离的线粒体在指定浓度下与下列化学物质孵育:白桦脂酸,20、40、60和200 μM;抗霉素A, 200 μM;顺铂200μM。融合样品以0.3% DMSO(药物溶剂的最高浓度)孵育作为溶剂对照。
六、线粒体膜电位分析(Δψm)
为了比较融合反应和药物治疗阴性对照之间Δψm的差异,从未转染HeLa细胞中分离的线粒体在FB或MTB的第1阶段和第2阶段以指定浓度白桦脂酸处理。然后, 测定Δψm,融合样品和阴性对照在200 μL的500 nM DiOC6(3)中重悬,在37◦C下孵育15分钟,用MTB洗一次,nFCM分析。
七、纳米流式检测
采用纳米流式检测仪(nFCM),使用488nm激光器(10 mW)和3个检测通道对单个线粒体进行分析。FL-1通道(520/35nm带通滤光片)和FL-2通道(660/52nm带通滤光片)分别检测GFP的绿色荧光和DsRed的红色荧光。在侧向散射、绿色荧光(FL-1)和红色荧光(FL-2)通道同时检测光子爆发。
八、 电子显微镜成像(略)
九、荧光成像(略)
十、Western blot检测分离的胞浆提取物中的Bid和Bax(略)
结果展示:
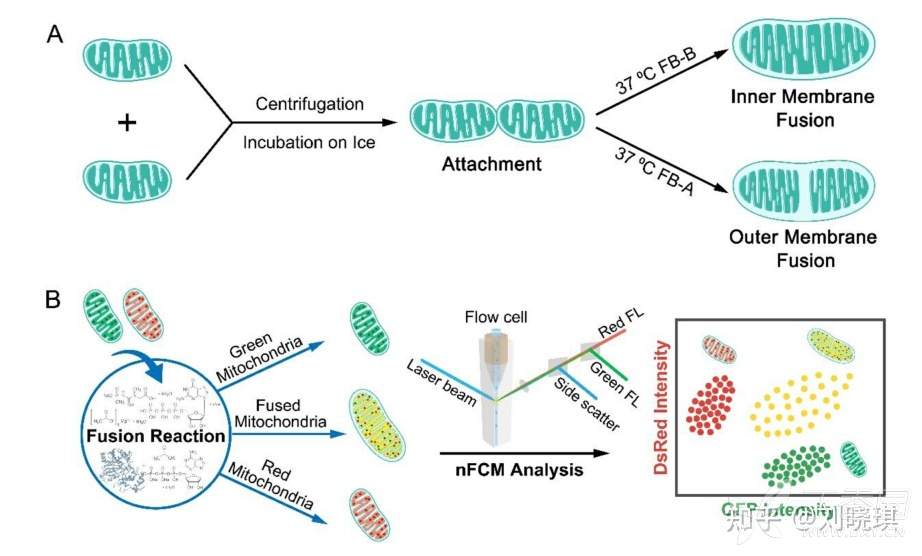
图1. 实验室构建的nFCM体外线粒体融合高通量多参数分析检测原理
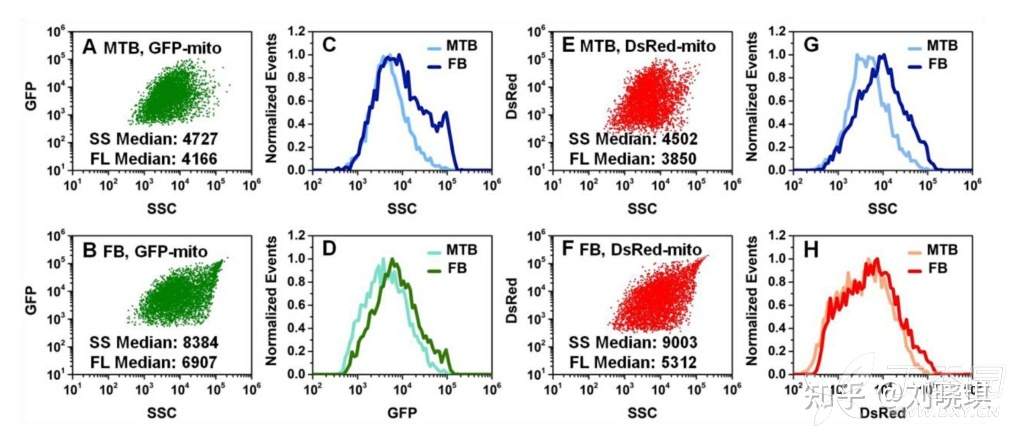
图2. 流式分析未融合和融合后的线粒体
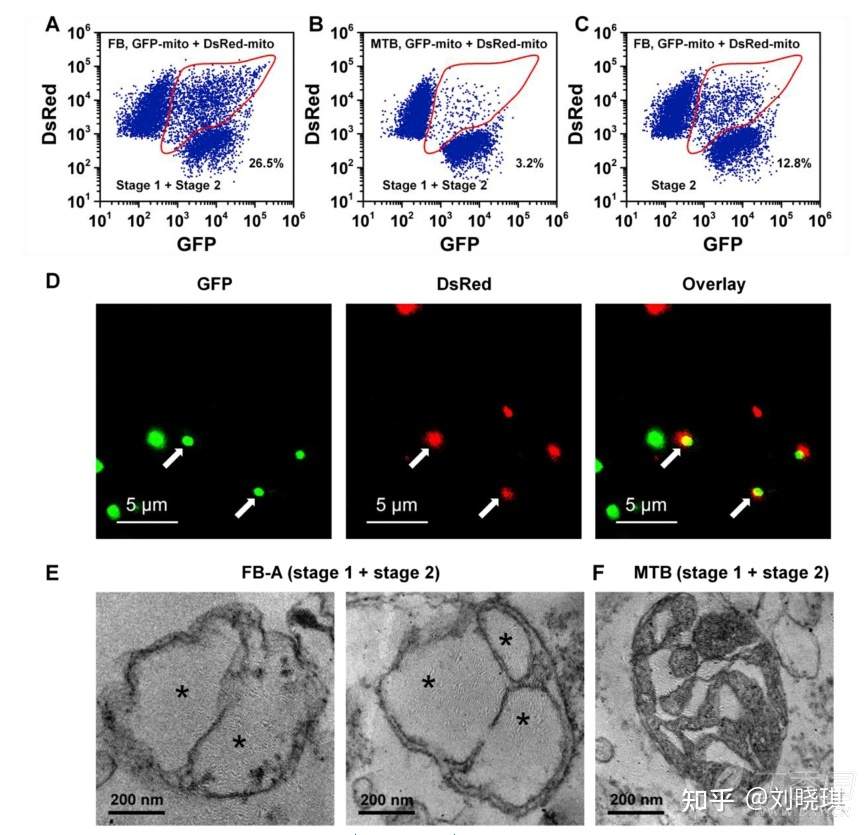
图3. 通过nFCM对线粒体融合进行体外定量测量,并通过共聚焦显微镜和电子显微镜观察融合结构
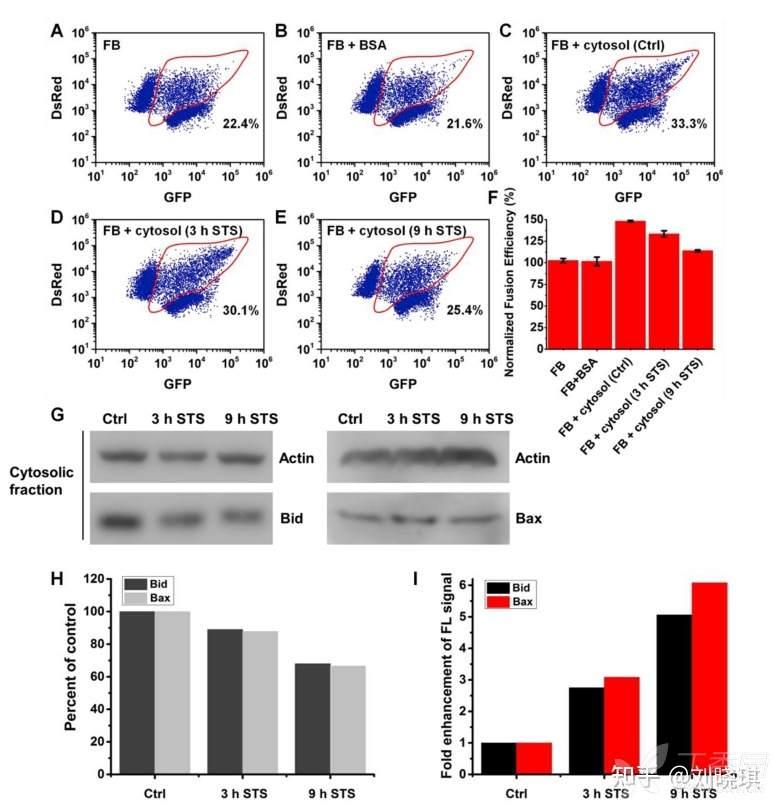
图4. 细胞质提取液和凋亡通路对体外线粒体融合影响的研究
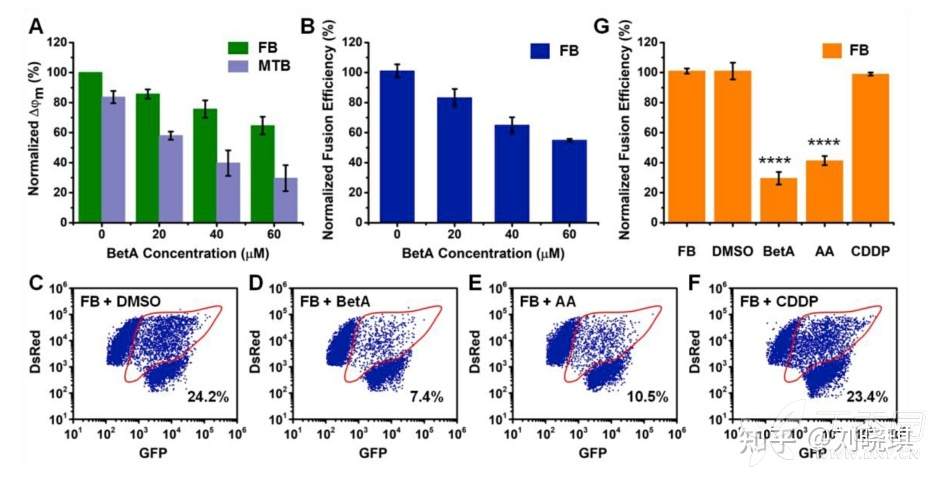
图5. 通过nFCM分析线粒体融合对细胞凋亡的作用及比较不同化合物对融合的效果
结果就展示这么多,有兴趣的话可以自己找这篇文献具体看,或者私聊我要文献资料,有理解得不对的地方,欢迎专业人士指正,一起交流~
参考文献:
[1]Xu, J; Su, L; Han, J; et al.Rapid and quantitative in vitro analysis of mitochondrial fusion and its interplay with apoptosis.[J].Talanta.2021,222():121523
















































