关于BV-2小胶质细胞(小鼠源)的培养与LPS刺激造模的交流讨论
 yj1984ren 推荐
yj1984ren 推荐楼主现在研二,目前在利用LPS刺激BV-2来造炎症模型,确认LPS有效后(即造模成功),通过预先给药,然后LPS刺激24h,看看药物能不能降低LPS刺激的炎症因子的表达量。
一、小胶质细胞的培养
1.我用的大皿养的,10%的血清全培DMEM,传代冻存的时候,BV-2都可以直接吹打下来,不用胰酶消化,在显微镜下观察能看到一些分支,大部分像眼睛状,中间椭圆两边有点尖尖的角,通过和国家实验细胞资源共享服务平台(附上网址http://www.cellresource.cn/cellsearch.aspx?sc=1&where=%E8%BE%93%E5%85%A5%E7%BB%86%E8%83%9E%E4%B8%AD%E6%96%87%E5%90%8D%E7%A7%B0&tdsourcetag=s_pcqq_aiomsg)对比,发现是正常形态
2.前几天师姐传给我一皿BV-2,养了一天,觉得状态不错,我就一传4,想多冻存一些细胞。细胞呈圆润状的居多,我当时就在想到底哪种形态才是小胶质细胞的静息形态(到现在我也没搞懂)?第一天观察后感觉细胞状态很好,当时可以用来铺板,也可以冻存,但是长的不是很满,觉得第二天早上冻存应该更合适。第二天早上看的时候,四皿细胞都漂浮的一些,于是其中两皿我没做处理,另外两皿每皿用3mlPBS洗了两遍,然后重新加了7ml的全培进去,下午观察的时候,未处理的两皿细胞漂浮的更多了,有三分之二;另外两皿居然奇迹般的活过来了,而且状态也不错(多数呈圆润状)。推测可能是前一天晚上的时候血清就已经消耗完了以及孵箱环境不是很好(很久没有清理了)。
3.关于BV-2直接吹打还是用胰酶消化,我碰到过这种情况,细胞前几次还很好吹打,突然就变的很难吹打下来了,我就加入3ml胰酶,盖上盖子,用手晃动几下,10s左右后就放到显微镜下观察,看消化情况,继续晃动几下,再观察,感觉消化的差不多了(前后1-2min),加入原先的培养液终止消化,后面就继续用来铺板、冻存或者传代,感觉直接吹打和胰酶消化区别不大。
4.小胶质细胞形态,我到现在都不清楚到底是有分支是静息状态还是圆润状的是静息状态,没找到很权威的资料。圆润状的细胞,我再加了LPS刺激后,与control相比,LPS刺激组分支确实明显增多;如果细胞一开始就是呈分支状的,LPS刺激组与ontrol在形态上区别就不大了。
二、LPS(1μg/ml)刺激BV-2造炎症模型
1.LPS(货号:L2880-10MG,sigma的),我直接把10mlPBS打进包装瓶中,吹打了4-5次,盖紧瓶盖,颠倒了几下,又吹打了4-5次,然后分装出3ml分成3管,做了第一次造模,跑的RT-qPCR,结果内参都没有跑出来,其它目的基因(TNF-α、iNOS、IL-6)有ct值,溶解曲线有两个出现双峰,有一个单峰特异性很好。溶解LPS的过程和师兄说了,他说我的LPS溶解的不均匀,于是我重新把分装的3管倒回去,吹打了70-80下,盖上盖子摇了好几次,然后又吹打了70-80下。qpcr试剂盒逆转录酶用的都是Takara的。
2.第二次换了一个别人用过的内参,PCR的退火温度从60°提高到64°,所有基因都跑出来了,且溶解曲线都是单峰,特异性很好,处理数据后,发现炎症因子的表达量不是很高,说明LPS刺激的不够明显。于是我在加入LPS前,做了血清剥夺1h处理,后面用的LPS也是用无血清的DMEM稀释的,后面连着做了三次,炎症因子的表达量就很高了。前面两次用的都是1%血清DMEM稀释的LPS。当然铺板前后用的都是1%的血清。
3.我做了4个时间点(3,6,12,24h)刺激LPS,看看刺激多久最明显,发现三个炎症因子inos是在24h最高,IL-6是在12h最高,TNF-α是在3h最高,后面呈下降趋势了。看到有文献用的都是24h,后面给药处理也就用24h了,但是预先给药1h后,LPS处理24h,最后的结果药物反而促进了炎症因子的表达,实验这些天就卡在这里了,不知道是不是药物的问题,现在增加了一个阳性药对照组,还没出结果。
4.想问一个问题,看到有的文献是药物加IL-4共同处理,然后LPS处理,可以检测出小胶质细胞M2型的表达量,文献里给出的解释是药物和IL-4有协同作用,感觉说的很模糊,IL-4的具体作用是什么?为什么药物或IL-4单独处理就不能增加小胶质细胞M2型的表达呢?
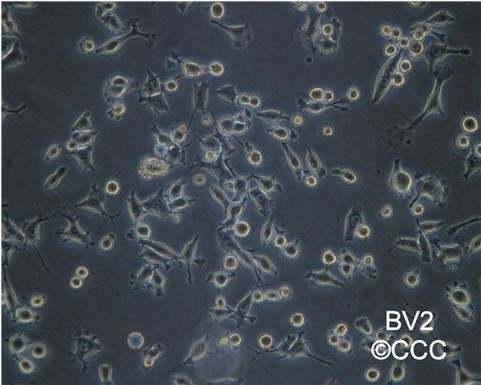
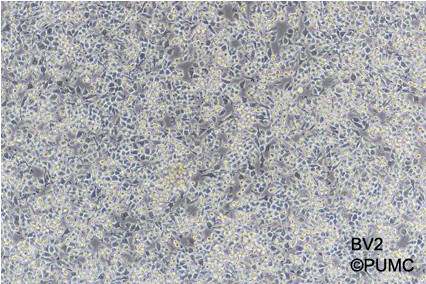
这两张是国家实验细胞资源共享平台上面的照片

这张是自己刚才拍的(20×),不知道大家能不能看到,格式有点问题,好像上传不了。















































