CNV分析工具之一:CNVkit
CNV分析的工具有好多,令人眼花缭乱,但是有个突出的问题就是目前来说没有哪一个分析工具取得明显的优势,对于笔者这种抱有想挑一个最好的工具使用的心态人来说,研究CNV时感觉莫名的苦恼,只能一个一个的试工具并学习这些分析流程。有段时间被CNVnator搞得头大,因为该软件安装异常的麻烦,各种报错、debug,所以分析工具是否容易安装也是其是否流行的重要因素。
最近笔者发现2016年发表在PLOS computational biology(IF=4.542)上的CNVkit目前引用率达到了74次,并被很多高分文章引用,该软件主要用python编写,容易安装,结果可视化也做的不错。2017年jimmy大神也写过一篇CNVkit的推文,好东西不嫌多写,这里笔者也写一篇CNVkit的推文以表对CNVkit开发团队的敬意,同时对自己也是以教促学(注:费曼学习法,这两天也是费曼的生日)。
下面来看下使用方法:
Github地址:https://github.com/etal/cnvkit
官方教程地址:https://cnvkit.readthedocs.io/en/stable/index.html
首先是使用conda进行软件安装:
conda config --add channels defaults
conda config --add channels conda-forge
conda config --add channels bioconda
conda create -n cnvkit cnvkit
source activate cnvkit
通过find找到cnvkit.py脚本的位置,找到其绝对路径,如/home/anaconda2/envs/cnvkit/bin/cnvkit.py,以后软件运行就可以用此路径使用cnvkit软件了。按官网的建议在ucsc上下载了人类hg38的参考基因组。同时在本地准备了几个人的WGS数据作为练习数据。
官方代码:
cnvkit.py batch *Tumor.bam --normal *Normal.bam \
--targets my_baits.bed --annotate refFlat.txt \
--fasta hg19.fasta --access data/access-5kb-mappable.hg19.bed \
--output-reference my_reference.cnn --output-dir results/ \
--diagram –scatter
解析:
cnvkit.py为运行的脚本
batch是脚本内的一个整合了很多命令的方法,当然也可以使用cnvkit.py提供的access、coverrage、fix等方法一起来完成和batch同样功能的分析,但是作为懒人还是建议使用batch。
Tumor.bam 和Normal.bam都是相应样本的bam文件,建议用bwa通过ucsc的hg38参考基因组做mapping,并用samtool排序转换成bam格式。这里可以输入多个tumor.bam和normal.bam
--targets 想要分析的区域信息
--annotate refFlat格式的基因注释信息,可以从UCSC上下载
--fasta 参考基因组
--access 需要跟bed文件,可用过cnvkit.py access mm10.fasta -s 10000 -o access-10kb.mm10.bed 生成
--output-reference 输出的reference.cnn可以作为下一批tumor数据分析的输入文件,reference.cnn和输入的normal.bam有关
--output-dir 输出目录名
--diagram –scatter 两个都是顺带绘图的参数
在解析好官方的方法后,就可以在自己的服务器上实践了,代码如下:
/home/anaconda2/envs/cnvkit/bin/cnvkit.py batch /data1/data-sample/human-WGS/bwa-sam-bam/700_bwa.sam.bam --annotate /home/genome/human-ucsc-hg38/ucsc-human-refflat2.txt --normal /data1/data-sample/human-WGS/bwa-sam-bam/699_bwa.sam.bam --method wgs -f /home/genome/human-ucsc-hg38/hg38.fasta --output-reference my_flat_reference.cnn -d 699vs700
首先使用cnvkit.py的绝对路径使用脚本,输入了两个bam文件:作为tumor的700和作为normal的699,输入了ucsc上下载的hg38的refFlat文件,由于是对整个基因组做分析,所以添加了--method wgs参数,输入的参考基因组也是在ucsc上下载的hg38。
运行后会报错(这种报错是我使用的服务器报错,并不代表通用报错),大意是少了DNAcopy这个R包,进入R后通过bioconductor下载安装此包。最近biocondutor有个问题是部分地方的网络无法使用,可以去官网下载安装包到本地,使用R CMD INSTALL xxx.tar.gz安装即可。
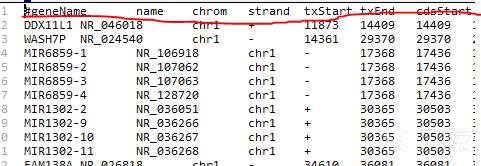
再运行还是报错,发现是refFlat文件有问题,通过查找发现官方提供的范本refFlat发现没有第一行的表头,如下图所示,去掉第一行的数据,再次运行就顺利跑完。
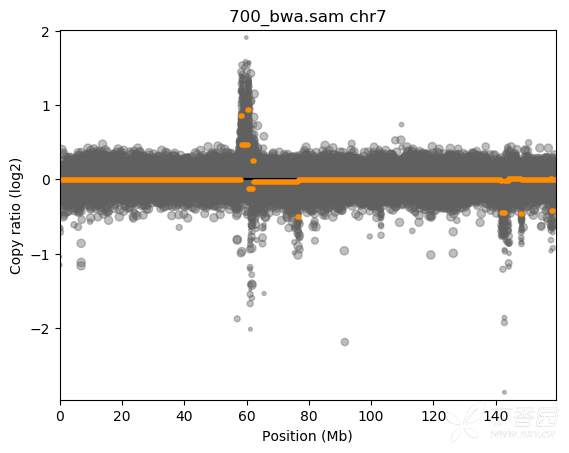
运行结果里我们会得到若干文件,其中700_bwa.sam.cnr是里面最重要的一个。因为我们参数里没有加包含--diagram –scatter参数,所以默认没有生成可视化图片。我们可以单独用命令行绘制需要的图片,如对7号染色体绘制scatter图:
/home/anaconda2/envs/cnvkit/bin/cnvkit.py scatter -s 700_bwa.sam.cn{s,r} -c chr7 -o scatter-chr7.png
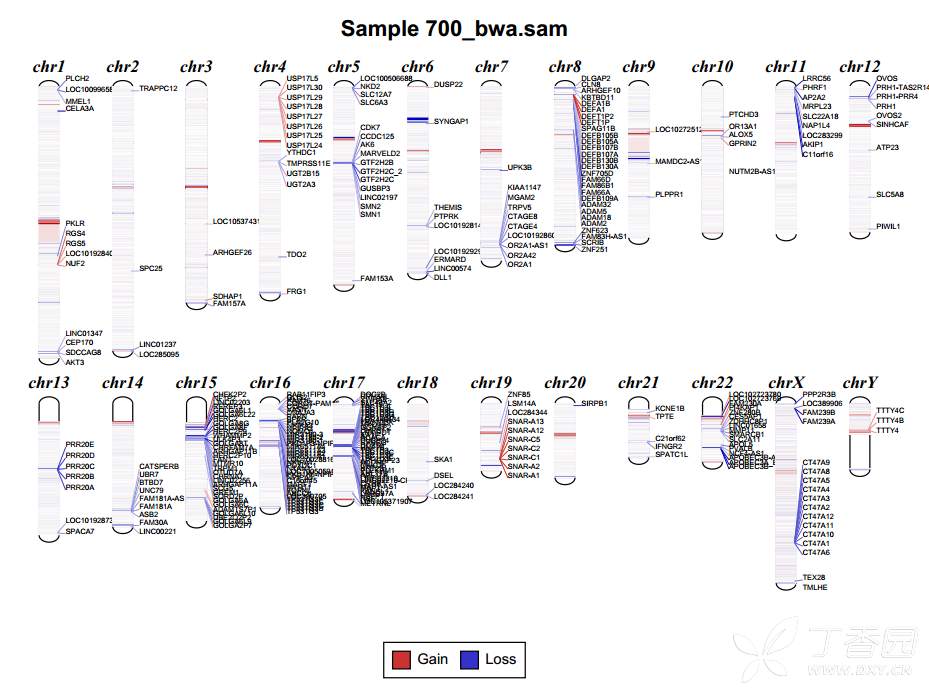
绘制diagram图,代码如下:
/home/anaconda2/envs/cnvkit/bin/cnvkit.py diagram 700_bwa.sam.cnr
结果是一个pdf文件,截图如下:
假设我们另一个tumor样本704要进行同样的分析,则不需要进行第一步的这么多的参数输入,只需要简化一下,使用之前生成的my_flat_reference.cnn文件即可,tumor样本是704,对应的normal样本还是699,-p 10为相应的线程数:
/home/anaconda2/envs/cnvkit/bin/cnvkit.py batch /data1/data-sample/human-WGS/bwa-sam-bam/704_bwa.sam.bam -r my_flat_reference.cnn -d 704 -p 10
从整体上看,笔者输入的bam文件平均有60GB,但实际运行一个CNVkit.py程序的时间约在1个小时之内,说明该软件的运行效率还是很高的。
本篇CNVkit的使用方法就介绍到这里。
转自生信草堂公众号,已授权