【一篇新作】什么样的杂质才有必要采用定量法检测?
 推荐
推荐什么样的杂质才有必要采用定量法检测?
原创 谢沐风 药通社 2021-09-13
针对杂质,业界主流认知为:与临床不良反应息息相关;因为息息相关,所以要做到“切勿漏检”和“切勿测错(含量)”。在切勿漏检上,CDE倡导“以源为始 —— 即以原料药的起始物料的合成路径为起点,从源头将所有可能、潜在的杂质一网打尽”思路;在切勿测错上,目前流行的作法是:不管含量如何(即便研究结果是未检出),研究过程和《质量标准》制定一概采用定量法测定已知杂质。
于是乎,如下研究模式在业界约定俗成、蔚然成风:查文献 + 自我狂想出一大堆已知杂质,且以数量论英雄 → 推翻既有质量标准中的色谱条件、自创色谱条件 → 所有已知杂质采用定量法测定(多采用杂质对照品外标法,故近些年对照品订制生意极其红火) → 开展全套方法学验证 → 测定规模化生产的三批研发申报样品(原料药+制剂) → 结果几乎全是未检出( ≤ ICH原料药报告限0.05%) → 不顾结果,《质量标准》中依然订入一大堆已知杂质和采用定量法检测。
本人数年前曾撰文驳斥杂质与不良反应息息相关观点,同时撰文反对以源为始的研究思路。此次再来论述一下“什么样的杂质才有必要采用定量法检测(否则限度法即可)”。针对这一问题,CDE主审李飞老师近日撰文提出“含量在报告限以上的杂质”,系因李老师在工作中接触大量《申报材料》,看到“研究结果都是未检出,很多企业还在劳民伤财地采用定量法检测,并开展大量方法学验证工作”,故撰文呼吁理性研究。
在此,对李老师主动为企业着想,为企业分忧解难,敢于在专业上做减法的勇气表示敬意和褒奖!但对所提出的“报告限以上杂质就需采用定量法测定”观点(图2左下),本人持反对意见、认为应是鉴定限以上。阐述如下:



一、 杂质检测方法
1. 定量法 又称准确法,测定结果准确。主要有(1)杂质对照品外标法 和 (2)主成分自身对照法(加校正因子)。
2. 限度法 又称笼统法,测定结果不是很准确。主要有(1)液相归一化法 和 (2)主成分自身对照法(不加校正因子)。
二、 杂质检测程序
所有检测都应先采用笼统法。当含量 < 报告限时无需积分、看作未检出;当报告限 ≤ 含量 ≤ 鉴定限时积分、给出含量,但无需开展任何研究;当含量>鉴定限时需知晓结构式、并改为准确法检测,因为连结构式都无需知晓的杂质,是没有必要采用准确法测定的。
三、 什么样的已知杂质、质量标准中有必要采用定量法检测?
1. 在产品整个生命周期中含量自始至终都不变化,但绝对值大于鉴定限。
2. 最初的含量小于鉴定限,但在稳定性考核中由于主成分降解(系指长期试验和加速试验,不包含影响因素试验;因为前者是对货架期的推断,后者不是),造成该杂质含量不断增加,最终超过鉴定限。
除以上两种情况,其他已知杂质均可采用限度法检测。总之,根据杂质研究结果确定质量标准中检测法。实际情况是:由于我国合成高手漫山遍野,所以、很多原料药中的已知杂质都是未检出(再不济,就多结晶几次,无非成本增加)。
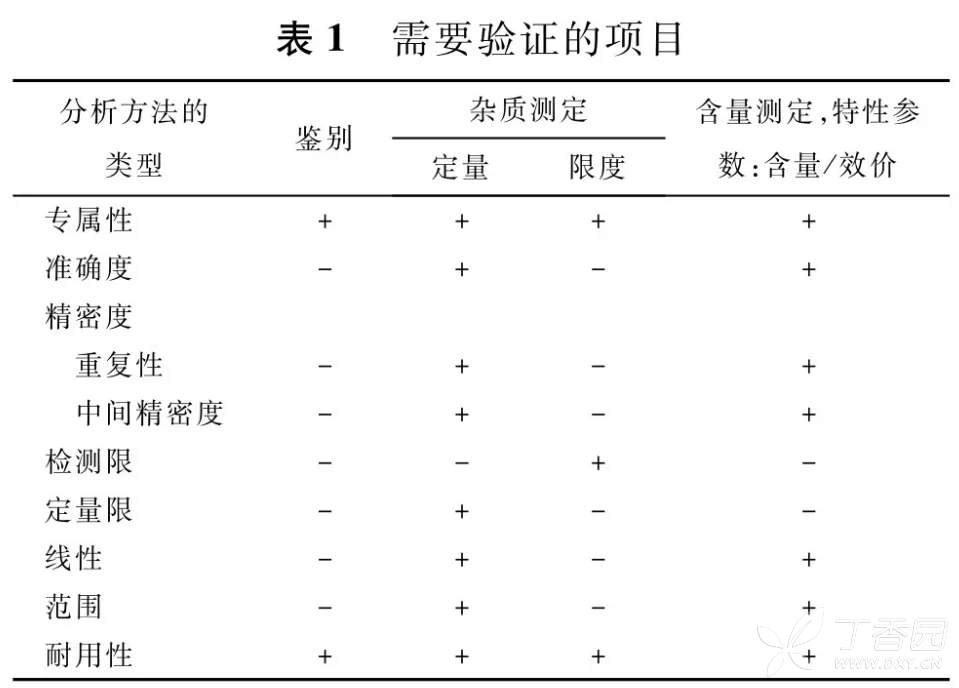
四、 方法学验证
根据质量标准拟定的方法来开展。由于采用定量法检测的杂质很少,所以,多数情况的验证均很简单,即开展右侧的“限度栏”项目即可。
五、 杂质的核心把握
针对鉴定限,原料药是0.10%,制剂是0.2%~0.5%(根据主成分每日摄入量)。
由于临床仅针对制剂,故制剂鉴定限才是重中之重;而原料药鉴定限,某种程度上完全可放宽至制剂的0.2%~0.5%,毕竟患者不会“生吃”原料药。
如按以上认知和思考开展杂质研究和制定质量标准,业界便可节省下海量(研发)经费;随后将这些经费用于药物有效性研究、用于效期研究、用于集采中标后的变更研究 —— 确保未来每批仿制药质量与原研药的一致等,这才是在下期望的仿制药康庄大道。
六、 分析工作的精髓
李老师在文末提到,“建立一个误差为零的分析方法是每个分析工作者的终极目标,但也是一个不可能完成的目标。分析方法验证的真实目的就是了解该方法最终提供给我们的数据的真实程度”。
恕直言,本人觉得这段话有些纸上谈兵、云里雾里了。“搞分析就是玩误差”,无需追求真值、只要测得数据满足工作需要即可(制药业的工作需要就是临床应用)。所以,不必苛求尽善尽美,不必总是疑神疑鬼,这不代表水平高,这只会造成专业过度、用力过猛。
【声明】
以上认知仅代表个人思考,不代表所在单位。还请异议者海涵,在此叩谢。
专业问题见仁见智,没有对错,每位同仁学完《ICH指导原则》都会有不同理解,只不过每次选择都是个人/公司/行业宿命的一次体现罢了。
【延伸阅读】
















































