如何诊断2020年明确的新疾病——VEXAS综合征?
VEXAS综合征是2020年新发现的体细胞突变所致的自身炎症性疾病[1]。所谓体细胞突变疾病,即非遗传性的基因所致。这注定其发病年龄相对偏大。
然而,2023年西班牙巴塞罗那临床医院免疫学系的一项研究对体细胞突变的时间点提出质疑。该中心纳入如下人群做研究[2]:
- 成年期发病(≥18岁);
- 无菌性炎症的反复发作跨越一段时间,即持续时间>6个月;
- 复发性多软骨炎和/或皮肤活检确诊的中性粒细胞皮肤病和/或静脉血栓和/或反复的关节炎和/或肺部症状;
- 活动性疾病期间血浆C反应蛋白(CRP)水平>0.5mg/dL和/或红细胞沉降率(ESR)>10mm/小时;
- 使用自身炎症性疾病的靶向基因组的遗传学研究中的阴性或非确认的基因型;
- 排除感染性原因;
- 反复测试时,循环自身抗体缺失或滴度低 (≤1/160);
- 存在血液学改变:(血红蛋白水平降低[<120g/L]和/或平均红细胞体积[MCV>100fL]和/或白细胞减少[<4×109/L]和/或血小板减少症 [<140×109/L])。
该中心根据上述标准,共42人纳入研究。根据基因检测,共发现30人携带UBA1致病性变异的患者。确诊的30人都为男性,均表现为迟发性疾病(平均67.5岁;中位67.0岁),其特征为皮肤病变(90%)、大红细胞症(72.4%)、发热(66.7%)、肺部表现(66.7%)和关节炎(53.3%)[2]。
这些临床表现并不出人意料,跟此前的的研究吻合。
但研究最大的出人意料的研究发现是:从9个确诊病患的指甲采集样本,所有的样本中都存在相应的UBA1变异(平均MAF 24.2%;范围2.7%-73.7%),尽管这低于造血组织中的平均MAF(60.5%,范围14.6%-86.3%)。
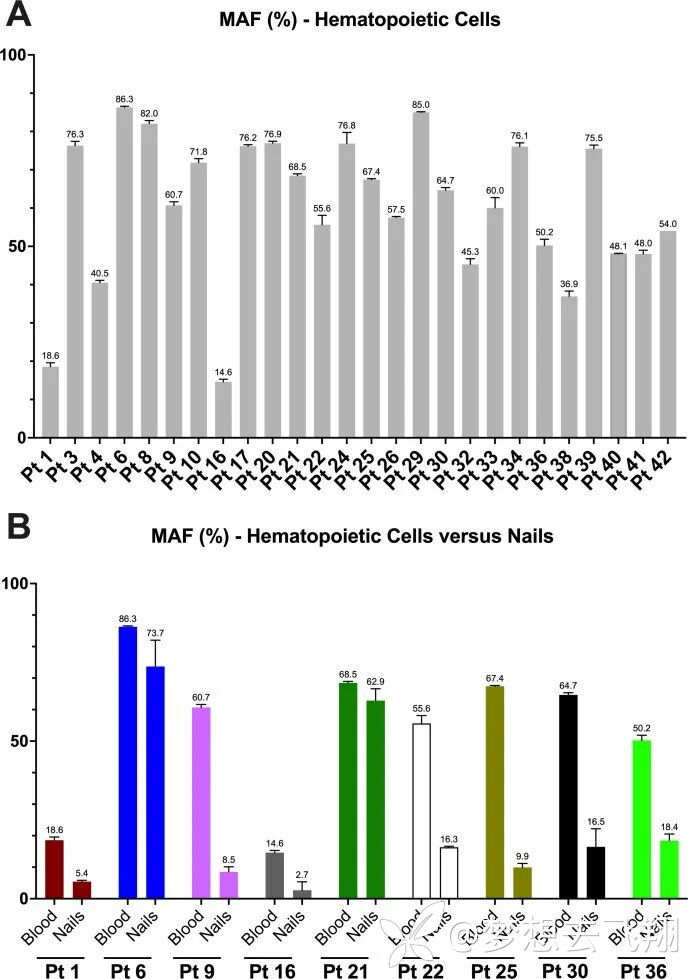
图1. A为造血组织中提取DNA样本获得的ADS结果;B为从造血组织与指甲提取DNA样本进行ADS分析的比较结果[1]
指甲提取的DNA样本好处是容易排除血液污染。因此,这可能表明外胚层和中胚层(分别导致指甲和血液的胚层)都携带UBA1变体。由此可推断,该基因的突变事件发生在胚胎发育的早期阶段,而不是经典认为的那样发生在成年期。
但问题来了:如果基因突变并非成年期发生,那么更早发生的基因突变为什么还等到50岁后发病呢?该研究未能回答病人为什么发病年龄偏大。
实际上,到现在为止还没有研究来明确UBA1变异引发的VEXAS综合征的自然病史(natural history)。
所谓自然病史,即在没有人为干预下,该类疾病的发生、发展、变化的自然过程。
比如,如果基因突变发生在胚胎期,那为什么本研究的病人发病的中位年龄是67岁?
再比如,病人最先出现的VEXAS综合征相关的病理改变是什么?有什么样的症状体征?
在自然病史不明的情况下,早期诊断就很盲目。根据笔者检索到的信息,VEXAS综合征患者大体的发病模式可能如下文所示。
皮肤表现起病
VEXAS综合征患者最常见的临床表现之一是皮肤病。
最初发现VEXAS综合征的报告里,88%有皮肤病表现,仅比大红细胞症(96%)、发热(92%)低[1](虽然骨髓空泡占比是100%,但最初研究里只有18个病人做了骨髓细胞学检查)。
而2025年的一项目前最大宗的综述性报告[3]:81.8%有皮肤病表现,是第一常见的症状,比全身炎症(含发热,69.4%),呼吸系统(61.3%)都更高。不过,该报告没有阐述大红细胞症的患病率。
尽管很多研究都注意到大红细胞症的高发病率(70%–100%)[1-2,4-8],但是这通常是无症状的。病人往往不会因此而求诊。
VEXAS综合征患者的皮肤病特征是[9]:
- 全身皮肤可受累,但以面部(52[56%])、上肢(41[44%])和躯干(42[45%])最常见。
- 皮疹形态:斑疹/斑块、结节、红斑、紫癜/瘀斑最常见.
- 皮肤病理:白细胞破碎性血管炎(23例[36%])、中性粒细胞性皮肤病(22例[34%])和血管周围皮炎(19例[30%])。
组织病理学分析提示皮肤受累有两种不同的模式:含有UBA1突变细胞的“克隆性”病变(中性粒细胞性皮肤病)和由炎症介质驱动的“旁克隆性”表现(白细胞破碎性血管炎),提示皮肤病表现的病理生理驱动因素不同[10]。
实际上,已有研究发现,皮肤病通常出现较早,在单独的病例系列中,45-61%的患者首次出现[9,11]。所以,对于慢性皮肤病,表现形式如上述,应怀疑VEXAS综合征可能。
(补充阅读:在2020年明确的新疾病----VEXAS 综合征的皮肤表现)
软骨炎起病
日本曾报道这样一个病例[12]:
一名75岁的日本男性因左耳垂肿胀持续2周看诊,就诊两个月后,右耳垂变得红肿。
实验室检查显示CRP水平升高至21.60mg/dL,大红细胞性贫血,血红蛋白水平为10.4g/dL,平均红细胞体积为100.3fL。髓过氧化物酶和蛋白酶3-抗中性粒细胞胞浆抗体阴性。
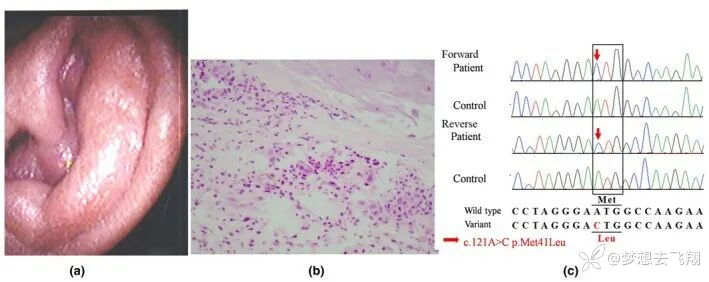
图2. 75岁的日本男性VEXAS病例[12]
对上图的解释:(a)左耳垂发红肿胀;(b)耳垂活检标本的组织病理学检查显示耳软骨炎,中性粒细胞浸润到耳软骨中(苏木精和伊红染色,原始放大倍数×400);(c)外周血单核细胞的基因组DNA测序证实了体细胞UBA1变异(NM_003334.3:c.121A>C,p.Met41Leu)。
患者10个月后出现虹膜炎。根据双侧耳软骨炎、眼部表现和耳垂组织病理学表现,诊断患者为视网膜色素变性,每天口服泼尼松5-20mg。
初次就诊三年后,患者出现周期性发热,血清CRP水平升高(8.63–30.16mg/dL)。患者接受口服泼尼松(30mg/天)强化治疗。
初次就诊四年半后,在颈背上观察到浸润的红色或紫罗兰色丘疹和斑块。皮肤活检显示致密的真皮中性粒细胞浸润伴白细胞破碎症。
外周血单核细胞DNA的基因组测序证实了体细胞UBA1变体(NM_003334.3:c.121A>C,p. Met41Leu)(图2c);骨髓检查显示骨髓增生异常综合征,红细胞和髓系前体细胞中存在液泡(图3a)。
最后,患者被诊断为VEXAS综合征。
初次就诊五年后,计算机断层扫描显示弥漫性双侧肺浸润性病变。不久后皮损突然恶化(图3b),涉及组织病理学上更强烈的中性粒细胞浸润和白细胞破碎性血管炎(图3c,d),提示VEXAS进展迅速。未观察到耳软骨炎或肺病变的恶化。此后不久死亡。
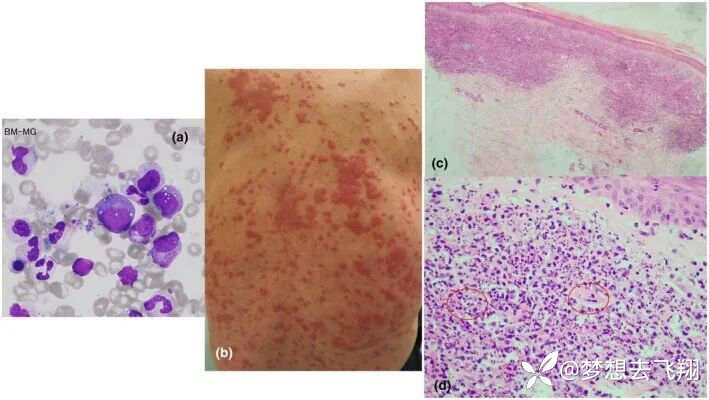
图3. 75岁的日本男性VEXAS病例[12]
对上图的解释:(a)骨髓检查显示骨髓增生异常综合征,红细胞和髓系前体细胞中存在液泡。(b)整个背部多处浸润的红色丘疹和斑块。(c、d)与之前的活检相比,背部的组织病理学检查显示严重变化。红圈:白细胞碎细胞性血管炎(苏木精和伊红染色,放大倍数×100和×400)。
病人的整体演变过程是:左耳软骨炎→双耳软骨炎,且发现大红细胞症→眼睛虹膜炎→周期性发热→皮疹,并确诊骨髓增生异常综合征(MDS)→双肺浸润性病变→死亡。
这是少数的按时间轴顺序展示VEXAS综合征病人病情演变的报道。
已有研究发现,复发性多软骨炎病人群里约7.6%其实为VEXAS综合征[13]。虽然未能明确这些病人是先有皮疹,还是先有软骨炎。
但根据日本的这一病例可以明确,的确一些病人是先有软骨炎而后出现皮疹、呼吸系统问题。
依据Ferrada等人的研究,在患有复发性多软骨炎的男性患者中,MCV的存在>100fL和血小板计数为<200K/μL,能够以100%的敏感性和96%的特异性区分VEXAS与非VEXAS的患者[13]。
(补充阅读《在2020年明确的新疾病----VEXAS 综合征的经典风湿病表现》)
呼吸系统起病
呼吸道问题也是很常见的。2025年的一项目前最大宗的综述性报告[3]:呼吸系统是第三常见的症状,仅次于皮肤、全身炎症反应(即发热、体重下降、显著的疲倦乏力)。
该研究显示[3]:61.3%(57.6-64.7%)的患者有呼吸道受累,最常见为肺部浸润(46.2%[41.7-50.8%])和呼吸困难(41.3%[35.6-47.3%]),而磨玻璃变化(17.6%)和胸腔积液(12.2%)发生的频率较低。
VEXAS综合征CT扫描模式显示出三种不同的表型[14]:机化肺炎样改变、非特异性单侧受累以及模拟双侧受累和纵隔淋巴结肿大的心力衰竭模式。
但是,有多少病人首发症状是呼吸系统?这还不清楚。但可以肯定的说,VEXAS综合征的肺部问题的基础是自身炎症性病变[3],而非感染性病变——尽管可能合并感染病变。
这可能需要提醒呼吸科医生,因为感染性呼吸疾病毕竟更常见,但这常见病患里有多少罕见病人被漏诊了呢?
(补充阅读《在2020年明确的新疾病----VEXAS 综合征的临床表现概述》、《在2020年明确的新疾病----VEXAS 综合征的其他表现》)
骨髓增生异常综合征
按照一般的估计,MDS是VEXAS综合征的相对晚期。
但是,的确很多病人因各种因素而迟迟没有确诊VEXAS综合征,并一路走到MDS阶段。
在有MDS和全身炎症特征的患者中检测UBA1突变,已发现12%-33%为VEXAS综合征[15,16]。
因此,血液科医生不可忽视那些反复炎症疾病的MDS,这或许是VEXAS综合征。
(补充阅读《在2020年明确的新疾病----VEXAS 综合征的血液病表现》
基因检测的对象
什么人群应怀疑VEXAS综合征,并行基因检测?
在612例男性巨细胞动脉炎患者中,未观察到VEXAS病例;同样,对不明原因血细胞减少症病例进行一般筛查,新捕获率为<1%[17];
就如前文提到的,静脉血栓是VEXAS综合征的重要表现之一,但是对首次发生静脉血栓栓塞的男性进行UBA1突变的一般筛查并未发现任何新的VEXAS病例;这说明单纯的静脉血栓栓塞并不能预告VEXAS综合征[18]。
日本横滨市立大学附属医院的一项研究报告提出一个积分系统来识别VEXAS综合征[8]:
- 年龄>50岁,积1分;
- 皮肤病变,积1分;
- 肺部受累,积1分;
- 软骨炎,积1分;
- 大红细胞症,积2分。
(皮肤、软骨炎、肺部等表现,请参考此前相关文章)
根据他们的研究,积6分者全是UBA1阳性患者,而≤2分者全部是UBA1阴性;积5分者,UBA1阳性患者多于阴性者。积3-4分,UBA1阴性人数>UBA1阳性人数。
日本的研究者也承认,大红细胞症可能在病情中后期出现,因此该积分评价体系未必能识别早期病患。实际上,该积分系统也未在更大规模人群做验证。读者应理性看待该积分体系。
笔者也提醒各位,应做好感染性疾病的排除。比如,HIV感染者,其实是容易有大红细胞症的[19]。
另外,慢性的全身炎症表现(反复发热、体重下降,显著疲倦)、男性易患等临床特征未在该积分体系里展示[3]。这是否会导致漏诊,还待进一步研究。
基因检测的程序
基因检测也有多个方式。比如[20]:
- sanger测序的灵敏度:等位基因变异分数(VAF)20%即可检出;
- NGS的灵敏度:当>2%–5% VAF即可检测出;
- 特异性数字液滴PCR的灵敏度:<0.5% VAF也可检出。
通常对骨髓抽吸物作为基因检测对象,但外周血也可以。
NGS基因组合中,UBA1的覆盖可以是靶向的(区域特异性),也可以包括完整的基因,包括内含/外显子边界,并且可以包括发现同时出现的髓系驱动基因,但更耗时且更昂贵。
sanger测序更快,成本更低。但存在因为灵敏度不够,可能漏诊VAF<20%的病人。
等位基因特异性数字液滴PCR(ddPCR)的灵敏度最高,但是检测范围有限,只能对区域特异性突变热点进行重点评估。
医生应跟检测单位仔细研讨检测方式的特征,局限性等,根据检测对象的风险度选择合适的检测方式。从而减少基因检测漏诊的风险。
VEXAS综合征集合:
2, 《在2020年明确的新疾病----VEXAS 综合征的临床表现概述》
3, 《在2020年明确的新疾病----VEXAS 综合征的皮肤表现》
4,《在2020年明确的新疾病----VEXAS 综合征的血液病表现》
5,《在2020年明确的新疾病----VEXAS 综合征的经典风湿病表现》
6,《在2020年明确的新疾病----VEXAS 综合征的其他表现》
罕见病合集:
2,《24岁女生全胃长满肿瘤-----此时应该做如何考虑?》
3,《罕见病(13):阵发性睡眠性血红蛋白尿伴自身炎症的临床表现与诊断》
5,《罕见病挑战(11):家族性白塞病样自身炎症综合征的诊断与治疗》
8,《罕见病(3):模拟狼疮的婴儿期发病的 STING 相关血管病》
10,《罕见的易误诊疾病红斑肢痛症》
12,《模拟类风湿关节炎的罕见病-----进行性假性类风湿样骨发育不良》
13,《独特的体征,独特的关节病》
15,《SPENCD:又一个单基因红斑狼疮样疾病》
16,《单基因狼疮样疾病----自身炎症 I 型干扰素病,是怎样的?(2)》
18,《抗核抗体阳性、抗 dsDNA 抗体阳性的“类SLE”疾病》
……
参考文献(上下滑动查看):
[1] Beck DB, Ferrada MA, Sikora KA, et al. Somatic Mutations in UBA1 and Severe Adult-Onset Autoinflammatory Disease. N Engl J Med 2020; 383:2628.
[2] Mascaro JM, Rodriguez-Pinto I, Poza G, et al. Spanish cohort of VEXAS syndrome: clinical manifestations, outcome of treatments and novel evidences about UBA1 mosaicism. Ann Rheum Dis 2023; 82:1594.
[3] Al-Hakim A, et al. Clinical Features in VEXAS syndrome: a systematic review. Rheumatology (Oxford). 2025. PMID: 40570089
[4] Koster MJ, Lasho TL, Olteanu H, Reichard KK, Mangaonkar A, Warrington KJ, Patnaik MM. VEXAS syndrome: clinical, hematologic features and a practical approach to diagnosis and management. Am J Hematol. 2024;99:284-99.
[5] Lacombe V, Hadjadj J, Georgin-Lavialle S, Lavigne C, Geneviève F, Kosmider O. Vacuoles in bone marrow progenitors: VEXAS syndrome and beyond. Lancet Haematol. 2024;11:e160-e167.
[6] Obiorah IE, Patel BA, Groarke EM, et al. Benign and malignant hematologic manifestations in patients with VEXAS syndrome due to somatic mutations in UBA1. Blood Adv. 2021; 5(16): 3203-3215.
[7] Olteanu H, Patnaik M, Koster MJ, et al. Comprehensive characterization of bone marrow biopsy findings in a large cohort of patients with VEXAS syndrome reveals distinct morphologic diagnostic features: a single-institution longitudinal study of 94 cases from 42 individuals. USCAP. 2023.
[8] Maeda A, Tsuchida N, Uchiyama Y, et al. Efficient detection of somatic UBA1 variants and clinical scoring system predicting patients with variants in VEXAS syndrome. Rheumatology (Oxford). 2024 Aug 1;63(8):2056-2064.
[9] Tan IJ, et al. Skin Manifestations of VEXAS Syndrome and Associated Genotypes . JAMA Dermatol. 2024 Aug 1;160(8):822-829.doi: 10.1001/jamadermatol.2024.1657.
[10] Lacombe V, Beucher A, Urbanski G et al Distinction between clonal and paraclonal cutaneous involvements in VEXAS syndrome. Exp Hematol Oncol 2022;11:6.
[11] Hines AS, Mohandesi NA, Lehman JS et al Cutaneous involvement in VEXAS syndrome: clinical and histopathologic findings. Int J Dermatol 2023;62:938–45.
[12] Kashino K, et al. VEXAS syndrome initially presenting as relapsing polychondritis and progressing into neutrophilic dermatosis with systemic symptoms over a 5‐year period . Int J Dermatol. 2025 Jul;64(7):1307-1309.
[13] Ferrada MA, Sikora KA, Luo Y, et al. Somatic mutations in UBA1 define a distinct subset of relapsing polychondritis patients with VEXAS. Arthritis Rheumatol 2021;73:1886–95. 10.1002/art.41743
[14] Borie R, Debray MP, Guedon AF et al; French VEXAS Group. Pleuropulmonary manifestations of vacuoles, E1 enzyme, X-linked, autoinflammatory, somatic (VEXAS) syndrome. Chest 2023;163:575–85.
[15] Delplanque M, Aouba A, Hirsch P, et al. USAID associated with myeloid neoplasm and VEXAS syndrome: two differential diagnoses of suspected adult onset Still's disease in elderly patients. J Clin Med. 2021; 10(23): 5586.,
[16] Zhao LP, Schell B, Sebert M, et al. Prevalence of UBA1 mutations in MDS/CMML patients with systemic inflammatory and auto-immune disease. Leukemia. 2021; 35(9): 2731-2733.
[17] Poulter J, Consortium UV, Morgan A, Cargo C, Savic S. A high-throughput amplicon screen for somatic UBA1 variants in cytopenic and Giant cell arteritis cohorts. J Clin Immunol. 2022; 42(5): 947-951.
[18] Khider L, Temple M, Bally C, et al. Systematic search for the UBA1 mutation in men after a first episode of venous thromboembolism: a monocentric study. J Thromb Haemost. 2022; 20(11): 2697-2699.
[19] North American AIDS Cohort Collaboration on Research, Design (NA-ACCORD) of the International Epidemiologic Databases to Evaluate AIDS (IeDEA). Evaluation of mean corpuscular volume among anemic people with HIV in North America following ART initiation. AIDS Res Ther. 2024 Aug 7;21(1):52.
[20] Koster MJ, Lasho TL, Olteanu H, Reichard KK, et al. VEXAS syndrome: clinical, hematologic features and a practical approach to diagnosis and management. Am J Hematol. 2024;99:284-99.















































