儿童肺炎衣原体肺炎39例临床特征分析
本文推荐引用格式:
许春娜, 汤昱, 赵顺英, 苏艳艳, 李晓, 张磊. 儿童肺炎衣原体肺炎39例临床特征分析[J]. 临床儿科杂志, 2025, 43(11): 866-871 DOI:10.12372/jcp.2025.25e0772
XU Chunna, TANG Yu, ZHAO Shunying, SU Yanyan, LI Xiao, ZHANG Lei. Clinical characteristics analysis of 39 cases of Chlamydia pneumoniae pneumonia in children[J]. Journal of Clinical Pediatrics, 2025, 43(11): 866-871 DOI:10.12372/jcp.2025.25e0772
本文作者:许春娜1 汤 昱1 赵顺英2 苏艳艳1 李 晓1 张 磊1
作者单位:1.郑州大学附属儿童医院呼吸科(河南郑州 450000 );2.首都医科大学附属北京儿童医院呼吸中心临床部二病区 国家儿童医学中心(北京 100045 )
摘要:目的 探讨儿童肺炎衣原体肺炎的临床特点,提高对该病的认识和诊治水平。方法 回顾性分析2024年7月至2025年5月收治于医院呼吸科并诊断为肺炎衣原体肺炎患儿的临床资料。结果 共纳入39例患儿,其中男20例、女19例。起病年龄10.9(7.8~12.5)岁。入院前病程(11±5)d,住院天数6(4~6)天。所有患儿均有咳嗽表现,部分有发热、胸痛、胸闷,少数患儿有肺部阳性体征。肺部CT表现为团状高密度影或斑片状实变影,多见于胸膜下,部分有支气管充气征、晕轮征,单肺受累34例,双肺受累5例,血白细胞计数、中性粒细胞占比、降钙素原、白介素(IL)-6均正常,C-反应蛋白12.8%升高,血沉50%升高,73.7%患儿IL-10升高。39例患儿血清肺炎衣原体IgM抗体均阳性,其中7例患儿行肺泡灌洗液二代测序肺炎衣原体核酸阳性,1例外院痰液肺炎衣原体核酸阳性。39例患儿中单用阿奇霉素抗感染治疗居多,其次是多西环素,5例加用糖皮质激素。36例患儿均达到临床治愈。结论 儿童肺炎衣原体肺炎可无发热,咳嗽为唯一症状,肺部病变多见分布于胸膜下的类圆形团块,病灶外围支气管充气征,可有晕轮征。确诊依赖于血清学抗体或核酸检测,阿奇霉素或多西环素治疗有效。
关键词:肺炎衣原体;白介素-10;胸部CT;儿童
肺炎衣原体(Chlamydia pneumoniae,CP)是衣原体科中一类独特的专性细胞内细菌样寄生物,其致病特性主要体现在对人类呼吸系统的侵袭,尤其可引发儿童社区获得性肺炎(community acquired pneumonia,CAP)。迄今为止仅发现了一种血清型,人类是已知唯一宿主[1]。肺炎衣原体肺炎(Chlamydia pneumoniae pneumonia,CPP)作为非典型肺炎的重要类型,在临床表现上与肺炎链球菌所致的典型细菌性肺炎不同,与病毒或肺炎支原体感染极为相似,这种临床症状的相似性,使得误诊成为CPP诊治过程中不容忽视的问题[2]。从流行病学来看,CPP的发生率在不同地区呈现明显差异,最新研究显示,韩国发生率为3.9%[3],伊朗达7.3%[4],我国苏州和山东则分别为6.0%[5]与4.53%[6]。由于CPP临床表现缺乏特异性,且很少引发大规模流行,国内相关临床研究与报道相对匮乏,导致临床医师对其临床特征的认知仍局限于既往经验,这无疑给当前临床诊断与治疗带来诸多挑战与困惑。本文系统回顾了39例确诊CPP患儿的临床资料,旨在为临床医师提供更详实的诊疗依据,实现早识别、精准病情评估与及时有效抗感染治疗,最大限度降低误诊误治风险,改善患儿预后。
1 对象与方法
1.1 研究对象
收集分析郑州大学附属儿童医院呼吸科2024年7月至2025年5月诊断为CPP患儿临床资料。
纳入标准:①年龄0~18岁,符合儿童CAP诊断标准[7]。②病原学检查(符合至少1项)[8-9]:A. 间接免疫荧光法检测血清CP-IgM抗体阳性(滴度不低于1∶16判定为阳性);B.痰液、支气管或肺泡灌洗液CP核酸阳性。③肺部CT显示团状高密度影或片状实变影。
排除标准:①混合其他病原体感染;②临床资料不完善者;③有基础疾病,如先天性支气管肺疾病、先天性心脏病、先天性或获得性免疫缺陷、血液肿瘤疾病。
期间共收治CPP患儿74例,排除7例临床资料不完善、28例混合感染,最终纳入39例患儿。
1.2 方法
1.2.1 临床资料收集 收集性别、年龄、病程、症状和体征、既往史,实验室检查包括血常规、C反应蛋白(CRP)、降钙素原(PCT)、血沉(ESR)、白介素(IL)-6(IL-6)、IL-10、病原学资料,收集支气管镜、影像学及门诊复诊资料以及电话随访。
1.2.2 标本采集 所有患儿住院24 h内抽取空腹静脉血及深部痰液检测,对合格的标本进行涂片和培养。
1.2.3 肺部影像学 患儿均进行肺部CT检查,观察病变类型及部位。
1.2.4 支气管镜检查 对有支气管镜检查适应证(双肺多叶受累,大片肺实变,常规抗感染治疗疗效不佳且未获得明确病原学依据)的患儿,家长均签署支气管镜知情同意书,行支气管镜检查术及肺泡灌洗术,观察患儿支气管镜下表现,并取灌洗液行病原学检查。
1.3 统计学处理
采用SPSS 27.0统计软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,两组间比较采用两独立样本t检验,非正态分布的以M(P25~P75)表示,组间比较采用秩和检验。计数资料以n(%)表示,组间比较采用χ2检验或Fisher精确概率法检验。P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况
共39例,男20例、女19例。起病年龄10.9(7.8~12.5)岁。入院前病程(11±5)d,住院天数6(4~6)d。患儿均有咳嗽,10例有发热,为中度热,热峰(38.5±0.8)℃。胸痛、胸闷4例。8例患儿有阳性肺部体征。见表1。

2.2 肺部影像学检查
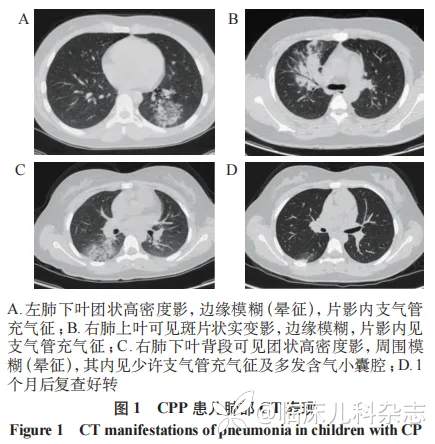
33例肺部CT表现可见团状高密度影,28例有支气管充气征,部分有晕轮征,21例分布于胸膜下,余6例为斑片状实变影。双肺受累5例,单肺受累34例,其中右下肺12例、左下肺10例,2例有囊状透亮影表现。见图1、表1。
2.3 实验室检查
外周血白细胞计数 8.4(7.0~10.9)× 109/L,中性粒细胞占比(60.32±9.61)%。C-反应蛋白为1.96(0.50~6.18) mg/L,5例升高。22例血沉21(10.5~35.0) mm/h,11例升高,占50%。37例PCT0.036(0.023~0.053) ng/mL,均正常,29例IL-6为3.52(2.61~6.80) pg/mL,均正常,19例IL-10为(4.49±2.82)pg/mL,14例升高,占比较高为73.7%。见表1。
2.4 病原学检测
39例患儿间接免疫荧光检测血清CP-IgM抗体均阳性,其中1例入院前其他三级医院检查痰液CP核酸阳性;15例患儿行支气管镜检查,其中7例送检肺泡灌洗液靶向二代测序(tNGS)提示单一CP核酸阳性。行痰液下呼吸道多重细菌和病毒核酸检测均阴性。痰液肺炎支原体核酸检测均阴性,血真菌D-葡聚糖检测、曲霉菌半乳甘露聚糖正常,15例行支气管镜检查真菌培养均阴性。
2.5 支气管镜检查
15例患儿行支气管镜检查,镜下可见局部灌洗部位有条絮状分泌物,2例可见痰栓。
2.6 治疗及随访
17例单用阿奇霉素抗感染,1例因症状控制不佳,考虑阿奇霉素耐药,换用多西环素治疗后治愈;14例单用多西环素抗感染,7例单用红霉素抗感染。5例因肺部病灶吸收缓慢,加用糖皮质激素治疗,治愈。39例患儿治疗疗程6(4~6)天,出院后随访1个月,39例临床症状均完全消失,复查胸部X线片或肺部CT评估,1例以团状高密度影为主要表现的单侧病变的病灶好转,余32例完全吸收;6例以斑片状实变影为主要表现的4例完全吸收,2例吸收50%以上。
3 讨论
CP是儿童CAP的病原体之一,多数情况下CPP呈轻度且自限性,在临床实践中常被忽视[10]。流行病学研究显示,CPP每四年出现一次周期性变化,北美地区发生率为8%,欧洲为7%,拉丁美洲为6%,亚洲、非洲地区为5%[11]。基于本中心既往诊疗数据,呼吸科病房CPP患儿收治率长期处于较低水平。但2024年9月法国马赛地区出现CPP流行高峰[12],结合本单位监测数据显示,自2024年下半年起,我院收治的CPP患儿数量呈现显著上升趋势,在此背景下,系统回顾并总结CPP患儿的临床特征,对提升临床医师对该病早期识别能力与规范化诊治水平具有重要的临床指导价值。
CPP的诊断主要依靠病原学,但国内外尚未就CP的诊断标准及检验方法形成统一共识。血清学检测被认为是金标准,CP-IgM滴度≥1∶16可诊断急性感染[6-7]。研究表明,基于聚合酶链式反应方法检测CP的检出率显著低于血清学方法[11]。本文中39例患儿血清CP-IgM抗体均阳性显示与临床的符合度很高,CP血清学试验为定性诊断,结合既往我院检测数据,假阳性率低于1%,39例患儿按照CPP治疗效果较好。通过7例患儿肺泡灌洗液二代测序检查结果示CP核酸阳性,1例外院痰CP核酸检测阳性,验证了血清CP-IgM抗体检测的准确性与可靠性。
本研究显示,多数患儿无发热,咳嗽可为唯一症状,这与近期研究报道一致[13-14]。在发病人群特征方面,不同地区呈现差异:墨西哥CPP患儿中男孩占比64%[13],印度达73%[15],日本占58.8%[16];韩国女孩占比则更高,达57%[3],秘鲁未观察到性别差异[17]。本研究数据表明,男孩占比51.28%,提示性别因素与CPP感染关联不显著。年龄分布上,本研究患儿年龄中位数为10.9岁,与其他研究报道的9岁以上[14]、8岁[18]结果相近,表明CPP高发人群已由既往5岁以上儿童转变为学龄期及以上。此外,患儿入院前病程平均为(11±5)天,结合患者多来自县市及基层医疗机构的特点,推测因基层临床诊治经验不足、检测手段有限,导致早期难以获取病原学依据,进而造成诊治延误,这也侧面反映出CPP初期临床特征缺乏特异性,易导致诊疗方向偏差。
在肺部影像学特征方面,CPP患儿肺部CT多单侧受累,且下叶病变显著高于中叶及上叶[14,19-21]。本研究数据进一步佐证该结论。与其他病原所致肺炎相比,CPP的肺部CT病变程度相对较轻,极少出现空洞及肺不张,典型表现为类圆形团块状影,病灶外围可见支气管充气征,部分伴晕轮征,少数呈现斑片状实变影。相较而言,肺炎支原体肺炎常表现为网状结节影或斑片状实变影,伴随支气管壁增厚、中央小叶结节,偶见肺门淋巴结肿大;军团菌肺炎则以快速进展的肺实变为主,CT可见致密实变影、结节性不透明区、磨玻璃样改变,常合并少量胸腔积液且多为双侧受累;细菌性肺炎可累及多个肺叶,呈现大片高密度实变影,易合并胸腔积液及空洞;病毒性肺炎的CT以磨玻璃影、网格影为典型,常伴支气管壁增厚及空气潴留征。这些影像学差异为临床鉴别不同病原感染提供了重要依据。
统计发现,73.68%患儿IL-10升高。既往研究表明,在成人哮喘及非哮喘个体中,CP感染可诱导IL-10的产生[22]。作为一种具有抗炎特性细胞因子,IL-10在CP感染过程中通过调节机体对病原体的免疫应答,发挥保护宿主细胞、避免过度免疫损伤的作用。然而,目前关于IL-10升高是否可作为儿童CPP的危险因素,国内尚未有相关研究报道。未来亟需开展更大样本、多中心的临床研究,进一步验证IL-10在儿童CPP诊断及病情评估中潜在价值。
大环内酯类和四环素类抗生素能够穿透宿主细胞,以破坏其DNA和蛋白质合成,对CP具有显著疗效,而CP对氨基糖苷类和糖肽类抗生素均表现出耐药性,目前尚未报道CP患儿耐大环内酯类菌株[23]。通过对39例患儿疗效分析发现,无论采用阿奇霉素、多西环素或者红霉素治疗,最终临床疗效无显著差异。在激素使用方面,目前CPP治疗中激素应用指征尚未统一。国外一项纳入21例CPP患儿研究显示,16例使用糖皮质激素,使用组与未使用组在年龄、性别、住院时间、发热持续时间和影像学结果方面无统计学显著差异[3];国内报道中,10例CPP患儿有4例因病灶吸收缓慢、病程长应用糖皮质激素[14]。本研究中,仅5例患儿接受常规剂量(1~2mg/kg)甲基泼尼松龙治疗,这些患儿均存在肺部感染面积较大、发热持续时间长,或经院外治疗后胸部CT复查改善不明显等情况。本研究有一定的局限性:研究数据仅来源于单一中心,且属于回顾性研究范畴;同时,受限于样本量相对较少,其研究结论对于国内CPP流行病学特征所具有的提示价值和推广意义可能存在限制。
参考文献:略
















































