Barrier Immunity|重新定义皮肤屏障:复旦大学过敏与疾病研究中心王久存团队系统综述

点击此处获取完整论文原文
文章要点
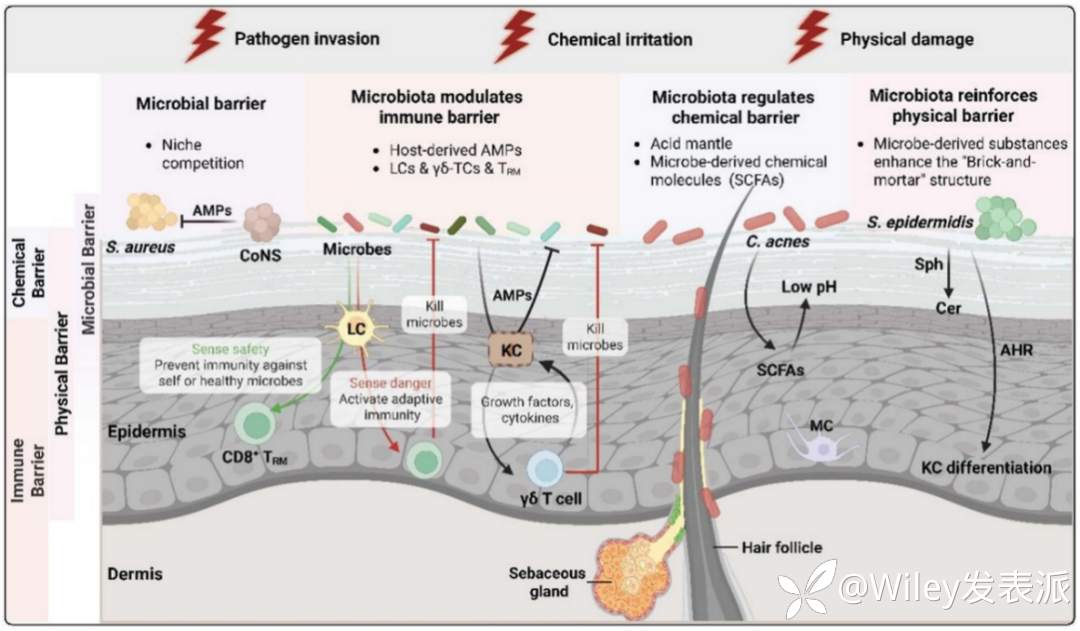
皮肤是一个协同的多层防御系统。本文首次将皮肤定义为一个由物理、化学、免疫、微生物四大屏障构成的动态界面,强调这些屏障并非独立运作,而是作为一个功能整合的整体,共同维持皮肤稳态。物理屏障主要由角质层和紧密连接构成,提供基础的结构完整性;化学屏障通过酸性pH梯度、抗菌肽和微生物代谢物,创造不利于病原体的微环境;免疫屏障由朗格汉斯细胞、组织驻留记忆T细胞和γδ T细胞等特化免疫细胞介导,负责免疫监视和快速反应;共生微生物构成的微生物屏障通过占位抵抗以及代谢和免疫调节来增强宿主防御。上述不同屏障系统之间存在广泛的相互作用,任何一个屏障的功能失调,都会引发破坏其他屏障的连锁反应,最终导致皮肤屏障疾病的发生。因此,在临床上对于皮肤疾病的治疗和屏障功能的恢复,必须摒弃孤立看待某个屏障的视角,转而采用一种统筹全局的整体性方法。
简介
皮肤是人体最大的“动态屏障”,兼顾体温、水电解质与稳态调控,并阻断机械损伤、紫外线、污染物、化学品和病原体入侵。传统认知中其屏障功能仅依赖物理结构、化学环境和局部免疫三大系统。然而,随着人类微生物组计划的深入,皮肤被重新定义为数万亿微生物的“生态系统”。共生菌通过占位、产酸、抗菌肽及代谢物,形成第四道“微生物屏障”,协同调控角质分化、免疫耐受与微生态平衡,从而放大前三道屏障的效能。
本综述聚焦皮肤四大屏障,重点解析免疫监视机制最新前沿,阐明微生物屏障如何协同物理-化学-免疫屏障强化皮肤的整体防御,并整合皮肤生物学、微生物生态学与系统生物学,为深入理解宿主与共生微生物之间的协同关系、维护皮肤屏障完整性与功能提供系统框架。
正文
1.物理屏障
皮肤的物理屏障主要由多层角质形成细胞构成,这些细胞经历约28天的增殖、分化与角化过程,最终形成无核的角质细胞。角质细胞与交联结构蛋白共同构建角质层及角蛋白包膜,形成结构致密的机械屏障,并为细胞间脂质提供支撑。该屏障系统与神经酰胺、游离脂肪酸和胆固醇组成的脂质双层共同作用,有效防止水分流失并阻挡外源物质渗透,这一结构被形象地称为"砖-砂浆模型":角质细胞作为"砖块",细胞间脂质充当"砂浆"。角质层承担约90%的屏障功能,其下方的颗粒层中紧密连接进一步强化屏障密封性,形成选择性通透的细胞间屏障。这种由细胞、蛋白和脂质协同构成的多层次系统,在维持皮肤稳态和抵御环境压力中发挥着核心作用。
2.化学屏障
皮肤的化学屏障由皮脂、天然保湿因子及酸性物质共同构成“酸幔”,形成弱酸性微环境,既能维持屏障功能完整,又可抑制病原微生物定植。该屏障的酸性环境依赖多种来源的有机酸:皮脂水解产生的游离脂肪酸、汗液中的乳酸以及微生物代谢的短链脂肪酸均具有抗菌活性,并能减轻外界刺激损伤。天然保湿因子来源于丝聚蛋白水解,包含氨基酸、乳酸和尿素等小分子,兼具弱酸缓冲与保湿功能。两种关键酶参与pH调控:分泌型磷脂酶A2通过生成游离脂肪酸降低表面pH;钠氢交换蛋白NHE1则通过离子交换维持酸碱梯度。值得注意的是,神经酰胺等成分在物理屏障中提供结构支持,其代谢产物又参与化学屏障的pH与水分调节,体现了不同屏障系统间的高度协同。
3.免疫屏障
免疫屏障依赖于表皮中特化的组织驻留免疫细胞群,包括朗格汉斯细胞(LC)、组织驻留记忆T细胞(TRM)和γδ T细胞(γδ-TC)。这些细胞与角质形成细胞、黑色素细胞等非免疫细胞共同构成动态防御网络,在免疫监视、稳态维持及屏障修复中发挥核心作用。
LC占表皮细胞的2%–5%,是表皮最主要的免疫细胞。其树突可穿透角质层,直接监视表面微生物。LC的双重功能包括(1)促炎与抗原呈递:通过MHC-I/II及交叉呈递激活T细胞;Langerin介导病毒捕获与清除;(2)抗炎与屏障维护:静默清除细胞碎片,防止DAMP积累;缺失LC可致屏障修复延迟,特应性皮炎中LC树突数量增加,可能为代偿性屏障修复反应。
TRM由全身免疫反应后定居于表皮的T细胞形成,具自我更新能力,以CD8+ T细胞为主。其功能特点包括(1)快速细胞毒性:激活后立即分泌细胞因子或杀伤靶细胞,清除病原及突变细胞;(2)屏障破坏风险:过度激活可下调loricrin等屏障蛋白,引发接触性皮炎;TH2/TH17细胞因子参与银屑病、特应性皮炎病理过程;(3)局部记忆积累:同一部位反复刺激致TRM局部增殖,导致疾病原位复发。
γδ-TC为先天样T细胞,具有限抗原特异性且不依赖MHC激活。其多元功能包括(1)稳态维持:持续分泌KGF-1/2、IGF-1等生长因子,保障角质形成细胞功能;缺失致表皮变薄、屏障破坏;(2)伤口修复:感知组织损伤后上调生长因子与IL-17,促进角质形成细胞增殖、迁移及细胞外基质重建;(3)精细调控需求:IL-17与IL-13水平需严格控制在生理范围,过低导致屏障瓦解,过高诱发银屑病或特应性皮炎。
4.微生物屏障
微生物屏障由多样化微生物群落及其代谢产物构成,其组成受年龄、性别、遗传背景、皮肤部位等内源性因素,以及紫外线、温度、护肤品和药物等外源性因素共同调控。本部分重点阐述了微生物屏障通过直接和间接机制调节皮肤屏障功能的路径与机制。
微生物通过三类进化策略实现生态位竞争与定植抗性。(1)资源竞争:包括营养争夺与空间占位,限制病原体生长与附着;(2)代谢竞争:分泌有机酸、细菌素等代谢产物,改变局部环境或直接抑制竞争者;(3)基因进化:通过水平基因转移获得抗性或毒力基因,增强生态位适应力。共生菌借此抑制病原体定植,并协助宿主免疫系统识别病原或建立对常驻菌的耐受。
微生物对物理屏障具有重要调控作用。表皮葡萄球菌通过激活芳香烃受体通路促进角质形成细胞分化与屏障修复。乳酸杆菌与双歧杆菌裂解物可增强紧密连接功能,而金黄色葡萄球菌则具屏障破坏作用。微生物还参与脂质代谢调控:表皮葡萄球菌将鞘磷脂转化为神经酰胺以维持水合,链球菌来源的亚精胺则有助于提升皮肤弹性。
微生物对化学屏障的调节作用。丙酸杆菌与棒状杆菌产生的游离脂肪酸有助于维持皮肤酸性环境,促进抗菌肽分泌并抑制病原体。山羊葡萄球菌通过群体感应干扰抑制金黄色葡萄球菌毒力,凝固酶阴性葡萄球菌则分泌抗菌肽直接抑菌。酸性环境还促进丝聚蛋白降解为天然保湿因子,增强保湿与防御;pH升高则导致屏障功能下降,并促进金黄色葡萄球菌与马拉色菌的致病行为。
微生物群与免疫系统形成动态平衡,其失调可驱动慢性皮肤病。无菌小鼠研究表明,缺乏微生物群会导致表皮变薄、经皮水分流失增加,且LC、γδ-TC与TRM数量下降,反映微生物在屏障稳态中的基础作用。LC作为表皮免疫哨兵,通过模式识别受体识别微生物。其在完整屏障下接触抗原可诱导免疫耐受,而在屏障受损时则启动免疫应答。LC还能诱导调节性T细胞分化,并依赖TAM激酶等通路维持抗炎状态。微生物代谢产物如短链脂肪酸,以及细菌合成的维生素K,均可调节LC功能与T细胞反应,影响特应性皮炎等疾病进程。
总结与展望
本综述把40年皮肤屏障研究凝练成“动态生态系统”统一框架:物理-化学-免疫-微生物四轴互作、双向调控,由此催生治疗范式革新:例如基于竞争排斥机制的微生物组靶向疗法——包括活体生物治疗与细菌素类抗菌药物,尽管其在临床应用中仍面临菌株特异性选择等挑战;芳香烃受体激动剂(如Tapinarof)可促进屏障与免疫互作的恢复,但其对皮肤微生态的长期影响尚需进一步评估;新兴“皮肤型”(cutotype)分类理念为个体化精准医疗提供了理论基础,但相关生物标志物的识别与分类模型的优化仍是当前主要难点。
未来,纵向队列+多组学+皮肤表面代谢物实时追踪将系统解析微生物代谢产物与宿主皮肤生理之间的因果关系。空间转录组、无菌动物模型等将深入揭示特定微环境中微生物与宿主的互作机制。面对皮肤屏障的复杂性,亟需融汇皮肤病学、微生物学、免疫学与生物工程等多领域知识,实现从机制解析到临床干预的全链条转化。随着研究从相关性向因果性不断深入,未来十年有望见证微生物组调节剂广泛应用于屏障相关疾病、AI辅助的皮肤型诊断体系建立,乃至可嵌入的微生物传感器构建“智能屏障”系统。最终,将皮肤视为“超有机体”而不仅是被动宿主组织的理念,不仅将重塑皮肤病学的未来格局,也将为肠道、肺等其他屏障器官的研究与治疗提供重要借鉴。
作者简介
通讯作者:Jiucun Wang,复旦大学华山医院皮肤科教授,复旦大学人类表型组研究院研究员,主要研究方向为皮肤病群体遗传学、皮肤屏障与微生物互作机制,主持国家自然科学基金重点项目、上海市重大科技专项等课题,在皮肤疾病的分子机制与转化研究领域发表多篇高水平论文。
第一作者:Jingjing Xia,华山医院皮肤科,复旦大学过敏与疾病研究中心PI,主要聚焦皮肤微生物组与慢性炎症性皮肤病的关联研究;Mathias Hochgerner,复旦大学人类表型组研究院博士后,在免疫细胞稳态调控领域有深入积累。
研究团队还包括Qingzhen Wei、Xian'ge Zhong,他们依托人类复杂表型的遗传与发育国家重点实验室、复旦大学人类表型研究所,长期开展皮肤屏障与微生物领域的跨学科研究。
期刊简介

Barrier Immunity 是由Wiley出版管理、全球发行、同行评议(Peer-Review)的开放获取(Open Access)综合性医学期刊,致力于成为传播高质量科学原创研究、综述及评论等的权威平台。作为一本同行评议的学术期刊,通过打破学科界限,为免疫学家、微生物学家、传染病专家、临床医生以及相关领域的研究人员提供一个全面的交流平台,促进跨学科合作与创新。本期刊旨在揭示免疫系统与机体所有重要器官屏障之间复杂而微妙的相互作用,从分子机制到临床应用,全方位探索免疫防御的奥秘。
期刊涵盖的主题包括但不限于免疫学、微生物学、传染病学、分子生物学、遗传及表观遗传学、临床医学等领域,以及针对屏障相关免疫反应的治疗干预等。
Barrier Immunity 主编陈万军 (Wanjun Chen) 教授为国际著名免疫学家,副主编和编委阵容强大,由来自全球包括美国、中国、日本、法国、韩国、英国等多个国家的知名专家和学者组成。咨询顾问委员会由来自全球的著名教授、院士组成,包括曹雪涛院士、Zhijian J. Chen院士、陈子江院士、董晨院士、Douglas R. Green院士、Stephen C. Jameson教授、Vijay K. Kuchroo教授、Warren J. Leonard院士、Xiang-Jin Meng院士、Alexander Y. Rudensky院士、邵峰院士、Akihiko Umezawa教授、王松灵院士、吴玉章院士、Howard A. Young教授和张水军教授。
期刊主页
https://onlinelibrary.wiley.com/journal/29941806
投稿系统
https://wiley.atyponrex.com/submission/dashboard?siteName=DNI2
作者指南
https://onlinelibrary.wiley.com/page/journal/29941806/homepage/author-guidelines
联系方式
Email: BIEditorialOffice@barrierimmunity.com
















































