Adv Sci 仁济医院何征宇团队EV介导整合素β1转移促免疫间质细胞交互作用加速肺纤维化
脓毒症(sepsis)是ARDS的关键启动因素之一,脓毒症相关性肺纤维化(sepsis-associated pulmonary fibrosis,SAPF)是脓毒症所致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)发展过程中的重要病理阶段,由肺组织急性炎症反应引起致纤维化微环境形成而促进肺成纤维细胞增殖活化并引起胶原蛋白在肺组织异常沉积所致,是ARDS患者死亡的重要原因。但目前尚未系统性阐明肺组织致纤维化微环境形成以及肺成纤维细胞活化的详细机制。

2025年8月,上海交通大学医学院附属仁济医院重症医学科何征宇及徐侨翌团队通过多组学技术联合体内外实验揭示了脓毒症引起糖代谢重编程产物琥珀酸诱导巨噬细胞内吞,通过分泌表达整合素β1的致纤维化细胞外囊泡(extracellular vesicles,EV)将整合素β1由巨噬细胞转移至肺成纤维细胞,通过介导免疫-间质细胞交互作用活化肺成纤维细胞并加速SAPF的全新机制,相关研究发表于Advanced Science杂志(IF:14.1)。
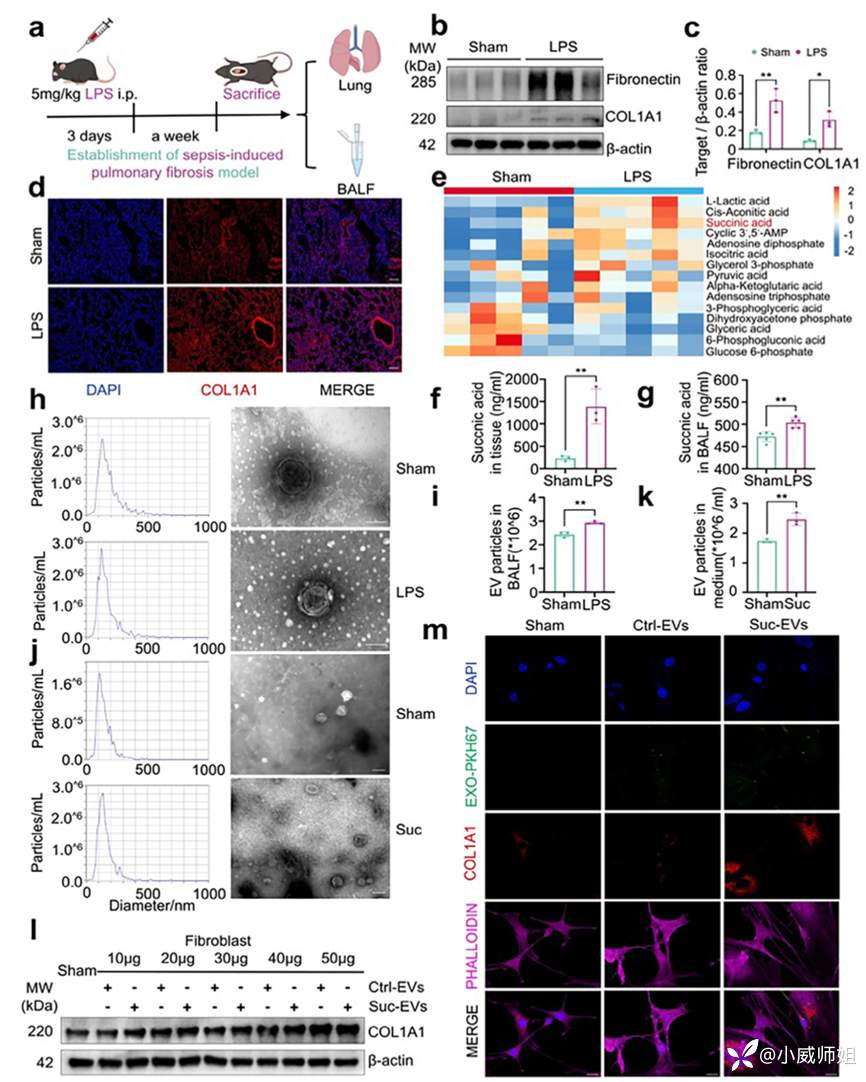
图注1:SAPF进程中琥珀酸增加伴随致纤维化EV释放
研究团队首先通过腹腔内注射LPS并通过组织病理染色确证SAPF的成功构建。利用代谢组学发现LPS组小鼠肺组织琥珀酸水平升高,随后采用HPIC-MS/MS技术发现小鼠肺组织及肺泡灌洗液(BALF)中琥珀酸的浓度同样增加。透射电镜证实了BALF中囊泡状双层脂质膜的存在,而纳米颗粒追踪分析(NTA)显示LPS促进EV的释放。鉴于巨噬细胞在这一过程中发挥重要作用,随后团队利用巨噬细胞开展体外研究,琥珀酸刺激巨噬细胞后检测发现EV分泌增加,收集EV进一步刺激成纤维细胞后发现其被不同程度的活化,其中琥珀酸刺激后产生的EV活化效果尤为明显。综上,LPS诱导的琥珀酸上升介导巨噬细胞释放致纤维化EV,并进一步活化成纤维细胞。
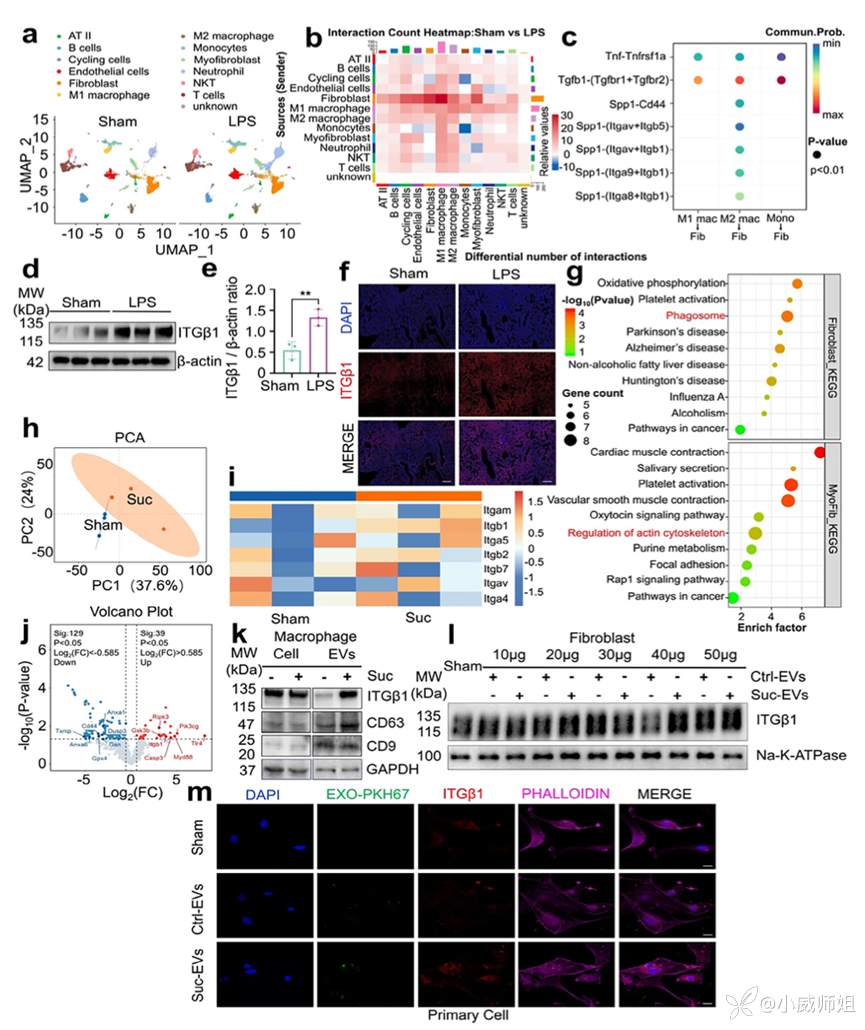
图注2:巨噬细胞来源的致纤维化EV转移整合素β1活化成纤维细胞
团队对假手术组和LPS组小鼠肺组织进行单细胞测序进一步探讨巨噬细胞和成纤维细胞的相互作用。基于CellChat的细胞通讯分析表明LPS增强细胞间通讯,在这一过程中整合素β1可通过与配体SPP1结合发挥重要作用,同时蛋白印迹和免疫荧光提示LPS组小鼠肺组织的整合素β1表达增加。KEGG富集通路显示成纤维细胞通过形成吞噬体调控肌成纤维细胞骨架促进ECM分泌。在机制层面,体外实验中对巨噬细胞产生的EV进行蛋白组学分析,发现EV中整合素家族尤其是整合素β1蛋白丰度差异变化显著。火山图显示EV具有致纤维化效应,并且蛋白印迹显示与细胞中蛋白对比而言,EV中整合素β1的蛋白表达差异更为显著。收集EV刺激成纤维细胞发现整合素β1剂量依赖性上调,其中40μg EV上调效果最为明显,免疫荧光得到同样结论。以上结果说明,巨噬细胞释放的致纤维化EV将整合素β1转移至成纤维细胞,介导其活化。
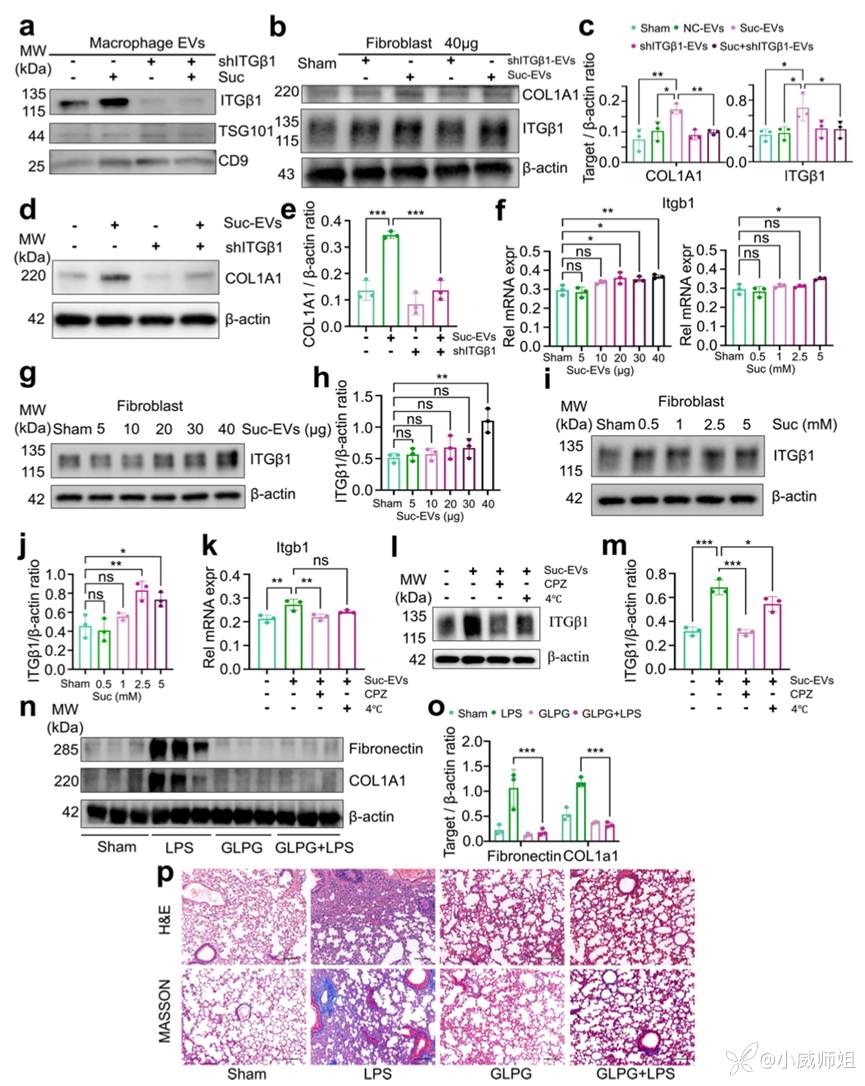
图注3:整合素β1对致纤维化EV释放,LPS诱导成纤维细胞活化和肺纤维化至关重要
为了验证上述现象,团队在巨噬细胞中敲低整合素β1,收集分泌的EV刺激成纤维细胞后发现其活化程度减弱。随后对成纤维细胞的整合素β1敲低再用琥珀酸刺激产生的EV处理发现其活化同样减弱。为排除琥珀酸直接引起整合素β1表达升高,团队对两种刺激基于基因和蛋白层面的变化进行对比,结果显示EV刺激更显著上调成纤维细胞中的整合素β1,且以蛋白水平变化为主,提示整合素β1的升高主要来源于外源性EV的转移。同时,抑制成纤维细胞的摄取同样会减少整合素β1的表达。基于以上结果,使用整合素抑制剂干预小鼠SAPF进展发现小鼠成纤维细胞活化、肺组织炎性浸润和胶原沉积现象得以缓解。综上,琥珀酸刺激巨噬细胞释放的致纤维化EV,通过转移整合素β1活化成纤维细胞,并对SAPF的发生发展具有驱动作用。
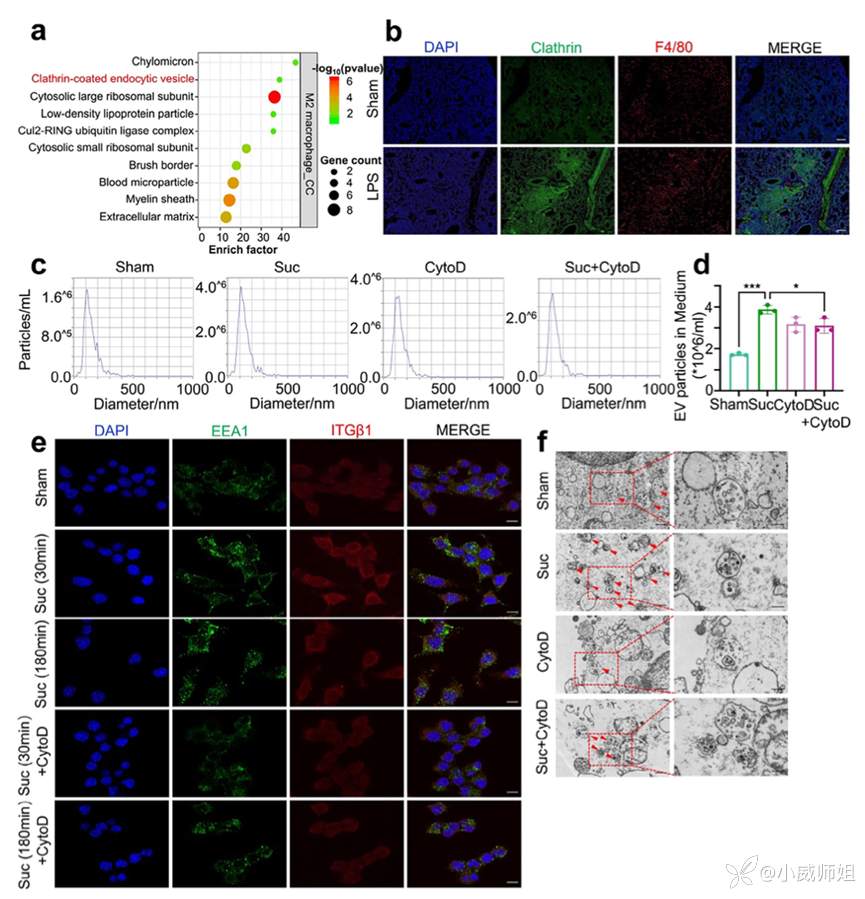
图注4:琥珀酸通过促进内吞,诱导多泡体形成介导巨噬细胞释放EV
为了进一步解析EV释放的机制,团队对单细胞中GO富集通路以及组织免疫荧光进行分析发现网格蛋白包被的内吞通路活化,在体外实验中抑制巨噬细胞内吞功能后发现EV释放减少。多泡体内包含的内腔小泡是EV形成的前体。短时间(30分钟和180分钟)使用琥珀酸处理巨噬细胞发现多泡体标志基因Rab5和EEA1上调,而抑制内吞后这一上调现象减弱。电镜显示琥珀酸增加了每个细胞中多泡体和内腔小泡的数量,而抑制内吞后该变化减弱。以上结果说明,琥珀酸通过促进内吞形成多泡体,介导巨噬细胞释放EV,抑制内吞可有效干预这一过程。
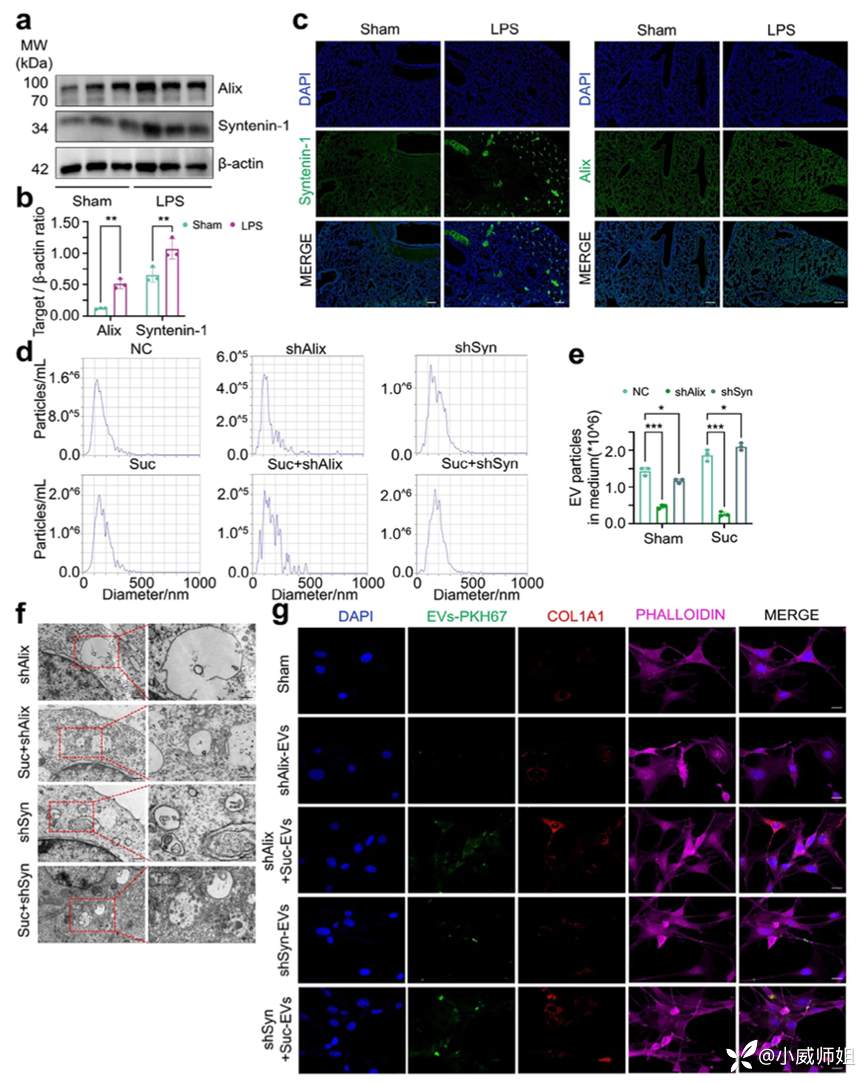
图注5:Syntenin-1和Alix调控内吞,驱动多泡体形成和EV分泌
ESCRT机制在膜出芽和将泛素化膜蛋白分选到特定内吞体结构域中发挥了重要作用。Syntenin-1是一种细胞质适配蛋白,将syndecans与ESCRT关键辅助因子Alix联结,调节内吞膜结构的出芽从而驱动EV的合成与释放。在组织层面,LPS增加肺组织中Syntenin-1和Alix的表达。巨噬细胞中,琥珀酸上调两者的mRNA但不直接促进蛋白表达增加,而分别对两个蛋白进行敲低后发现EV释放减少,多泡体结构破坏,EV刺激成纤维细胞的活化程度减弱,其中敲低Alix的效果更为明显。
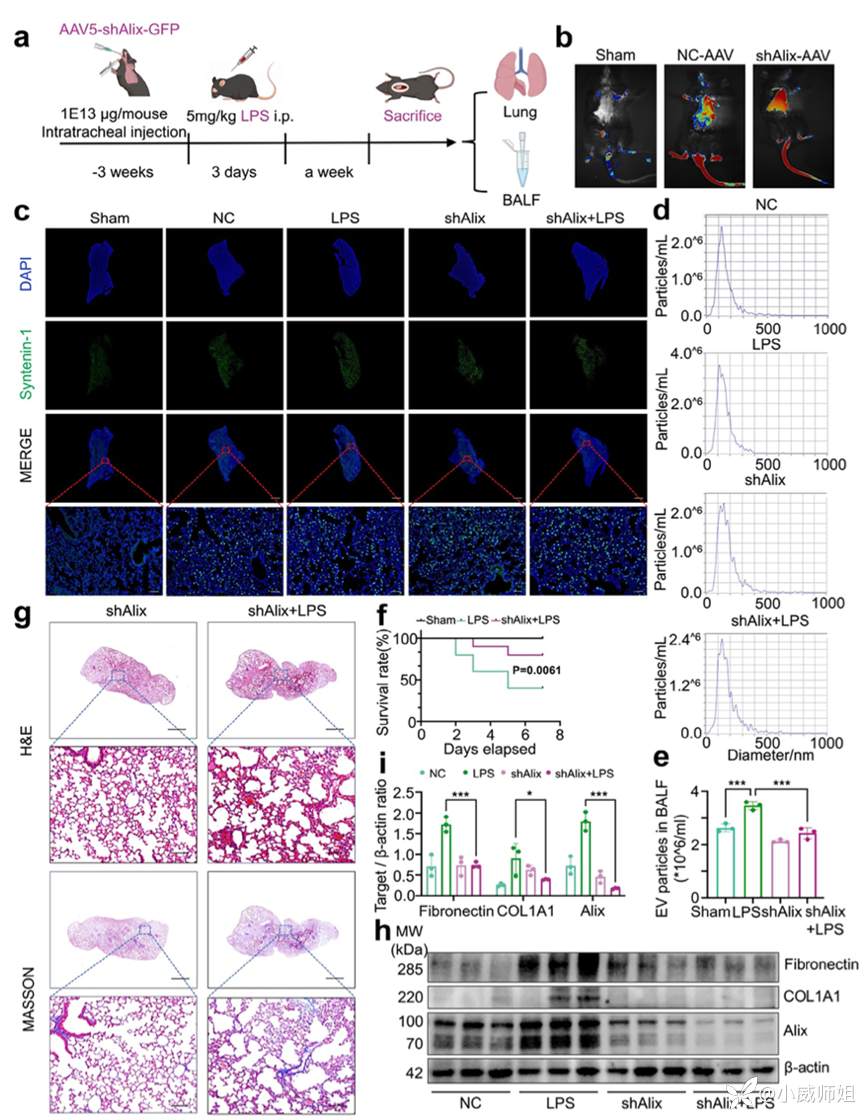
图注6:靶向Alix抑制LPS诱导EV分泌,缓解SAPF
为验证Alix在SAPF中的关键作用,团队构建AAV5腺相关病毒经气管内注入Alix-shRNA至小鼠肺部内,在验证了病毒感染和敲低效率后收集小鼠BALF检测发现敲低了Alix后EV释放减少,同时显著降低LPS相关死亡率(第5天由80%下降至20%),炎性浸润和胶原沉积程度减轻,成纤维细胞活化标记基因Fibronectin和COL1A1表达下降。总之,Alix作为EV生物发生的关键调控节点,参与SAPF的发病进展,靶向干预Alix可抑制LPS诱导的EV分泌,缓解肺纤维化并有效改善小鼠生存率。
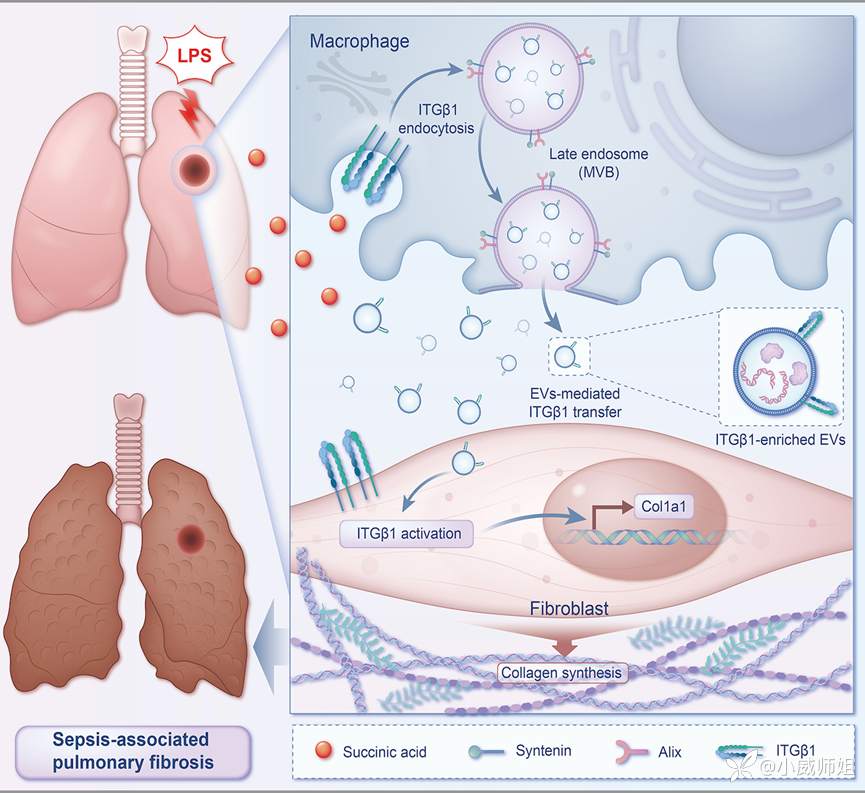
综上所述, LPS刺激肺组织中琥珀酸的产生,促进巨噬细胞的内吞和MVB的形成。这些多泡体释放致纤维化EV,促进整合素β1的转移,并随之激活成纤维细胞,从而加重SAPF的病程进展。本研究从致纤维化EV介导整合素细胞间转移促进致纤维化微环境形成并介导免疫-间质细胞交互作用的角度探讨巨噬细胞促进肺成纤维细胞活化的细胞和分子网络调控机制,进一步丰富了脓毒症相关性肺纤维化的发病机理研究。
上海交通大学医学院附属仁济医院重症医学科博士研究生杨雯雨、医师汤日为论文的第一作者;主任医师何征宇、主治医师徐侨翌为论文的通讯作者。该研究获得国家自然科学基金面上项目、上海市东方英才计划拔尖项目等课题的资助。
















































