ACPA——类风湿关节炎的最重要生物标志物
前言
类风湿关节炎(RA)作为经典的风湿免疫性疾病而被大家熟悉。
RA被认识是逐渐深入的。医学界先是于1930-1940年代发现了类风湿因子(RF)可作为RA的生物标志物[1-3];而后于1998年,由Schellekens和他的同事们发现抗瓜氨酸肽抗体(ACPA)[4]。到今天,ACPA被认为是类风湿关节炎诊疗里的最重要的生物学标志物,没有之一。
ACPA的认识历史
1914年,Koga和Ohtake从西瓜汁中分离出非必需氨基酸瓜氨酸[5];Rogers等人的进一步研究表明,瓜氨酸是通过肽基精氨酸侧链“酶促”转化为肽基瓜氨酸,这是一个称为脱亚胺或瓜氨酸化的钙依赖性过程[6-8]。负责该反应的酶于1981年被Fujisaki和Sugawara部分纯化,并被命名为肽基精氨酸脱亚胺酶(PAD)[9]。
1950年代,芝加哥的Robert M.Kark实验室开始使用来自健康人口腔粘膜的上皮细胞涂片作为抗核抗体检测的底物[10]。1959年,荷兰医生Enno Mandema拜访Kark博士,他们一起用口腔粘膜涂片进行抗核抗体研究[11-12]。
1964年,Enno Mandema和Bob Nienhuis发现RA患者的血清含有一种因子,可在人颊粘膜的上皮细胞上产生一种独特的染色模式,称为抗核周因子(APF)。当使用来自动物(即肾脏、肝脏、甲状腺、胃和肾上腺切片)和人类(即软骨、滑膜和阴道涂片)的其他组织作为抗原时,这种模式是无法检测到的[13]。他们得出结论,APF是一种靶向人口腔粘膜中化合物的新型抗体,该化合物在其他组织中不存在或以不同形式存在[13]。
15年后,即1970年代后期,Terry J.Hamblin的小组注意到,很大一部分抗角蛋白抗体(AKA)阳性血清的RF也呈阳性,这引起了AKA在RA中相关研究的热潮[14]。
他们发现58%的RA患者是AKA阳性,而这些抗体仅在1.9%的其他非RA自身免疫性关节炎中呈阳性,在健康对照中不存在;他们还证实AKA与RF不同,表明它们是RA中的一种新型自身抗体[14]。
虽然APF和AKA都没有广泛用于RA的临床诊断,但它们的偶然发现为后续的研究提供了框架,引导后来的Guy Serre的小组取得了研究突破,即两种抗体都靶向相同的抗原[15-16];接着就是Schellekens及其同事发现瓜氨酸化残基是APF/AKA抗原识别的主要决定因素,即是RA患者自身的主要靶标[4]。
很快学界就发现,相对RF,ACPA对于RA的诊断具有更高的特异性。尽管在2010年新的RA诊断分类标准里,ACPA和RF有同等地位的权重。但这个观点遭到了挑战,越来越多的学者建议修改诊断分类标准,降低RF的权重,同时提升“RF与ACPA并存”和“单纯ACPA阳性”的权重[17-18]。(对照《类风湿因子——最熟悉的陌生人》)
在RA发病过程中
ACPA的作用和价值
根据献血库的标本的连续性检测,很多类风湿关节炎患者在无症状时期已经有ACPA阳性[19]。这说明ACPA对诊断RA有一定预告价值。
那么ACPA的普遍阳性率呢?对荷兰无选择的超过4万人的检测发现[20]:
- 401例(1.0%)有ACPA阳性;其中90例(22.44%)有RA(61例归入研究者定义的RA,另外29例是自我报告RA);
- 在排除了RA的人群里,311例(0.8%)为ACPA阳性;这些确定无RA的ACPA阳性者,其年龄通常更大,有吸烟,以及有关节主诉。
那么问题来了,这个队列里的无RA的ACPA阳性者在未来得RA的概率呢?
2年后随访其中的308例(因为有3例未参与研究):10例参与者报告确诊RA;75例被发现有临床疑似类风湿关节炎的关节痛,102例被定义为无临床疑似类风湿关节炎的关节痛[21]。(注解:临床疑似类风湿关节炎的关节痛是基于欧洲抗风湿病联盟的定义)
荷兰的这个研究说明,ACPA阳性的确有较好的预告RA的价值。比如,随访2年里确诊RA的人,在基线检测时就发现[21]:
- 10例都报告了关节僵硬以及关节、手和手腕疼痛的阳性结果;9例报告抱怨>3个月,且是身体两侧,5例报告难以握拳,4例手部和手腕肿胀,3例晨僵>6周。
- 7例有IgA-ACPA和IgM-RF血清反应阳性,5例还有IgA-RF,2例有抗CarP阳性。
75例有临床疑似类风湿关节炎的关节痛,在基线检测时的IgG-ACPA、IgA-ACPA和IgM-RF水平显着更高,尤其是IgA-ACPA可以更好用来跟“临床未疑似类风湿关节炎”做区分[21]。
请注意,荷兰的这个研究只是追踪了2年;如果时间跨度是5年,甚至更长时间呢?那么有多少ACPA阳性者会转变RA病人?至少那75例有临床疑似类风湿关节炎的关节痛者的风险偏大。
总结荷兰研究:同时有ACPA和RF阳性者更容易发展为RA,如果有IgA类型的ACPA阳性则有更强的预告价值。
既然ACPA具有预告价值,那它是如何发挥作用的呢?
可以肯定的说,RA是基因与环境相互作用的结果。起始事件可能是环境因素刺激黏膜表面,例如气道暴露于烟草烟雾。然后诱导肽基精氨酸脱亚氨酶(PAD),将精氨酸转换为瓜氨酸来修饰多肽结构。修饰后的蛋白又被树突状细胞(DC)等抗原提呈细胞(APC)加工后提呈至T细胞。这些事件不仅发生于黏膜,也可见于中枢淋巴器官,导致局部和全身产生针对上述经修饰多肽的抗体[22]。
循环中的ACPA和细胞因子会在RA症状出现前的数年期间逐渐增加。虽然导致滑膜炎的直接事件尚不清楚,但可能需要二次“打击”,例如形成免疫复合物以增加滑膜血管通透性并激活滑膜细胞。随后,小分子炎症介质、自身抗体、细胞因子、生长因子、趋化因子和基质金属蛋白酶(MMP)将促进关节炎的发生和长期存在。滑膜炎还可激活关节中的间质细胞,使其表现出攻击行为,可以侵入并破坏软骨,同时破骨细胞会破坏软骨下的骨质,这就是RA发病整体过程。
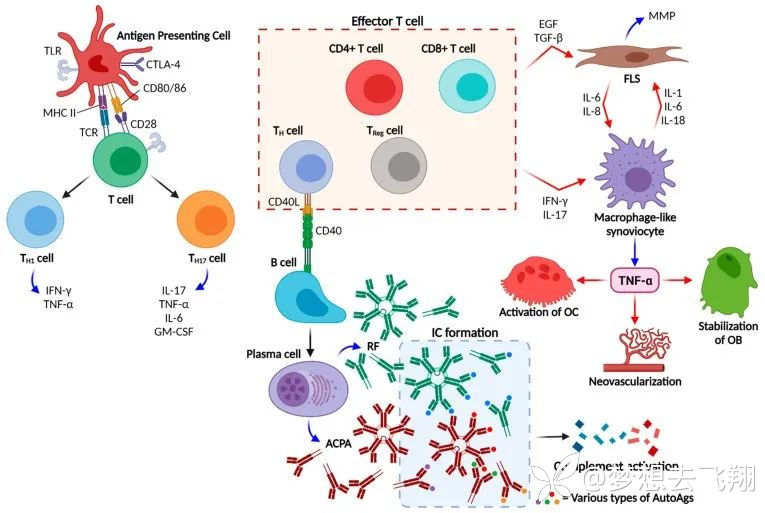
从炎症介质到抗体产生,以及关节损伤的发生的整体过程
ACPA的检测
1,检测人群
任何检测都首先要考虑选择哪些人做检测。
就如前文所述,对类风湿关节炎患者的血清连续检测提示,在发病前已经有ACPA阳性[19,21]。
那么,能否对所有人普遍筛查ACPA,一旦血清阳性则可以更早诊断RA,并提前干预治疗?
荷兰研究就是一个无选择的研究;然而,就如荷兰研究所示,ACPA阳性中为确诊RA病人是不多的,第一次检测401例阳性里只有90例(22.44%)是RA病人,这其中还包括了病人自我报告的RA但不符合研究者定义的[20]。对于不是RA病人的ACPA阳性者追踪2年,也只有10例后续确诊是RA[21]。虽然追踪时间偏短,后续可能还有人会进展为RA,但预计并不会很多。
由此可知,普遍性筛查ACPA是没有意义的。这会浪费很多医疗资源,且增加筛查者的恐慌。
为此,有研究者设计了一个筛查机制,即选定“临床疑似关节痛(CSA)”患者。这些是没有临床关节炎的患者,近发作(<1年)有手或足关节关节痛,根据风湿病学家的临床专业判断,他们被认为有进展为RA的风险,符合CSA定义的241例病人,随访2年:44例达到临床关节炎标准;其中3例在达标后自发消退,41例为持续性的临床关节炎;根据基线的抗体检测结果来看有多大概率进展为临床关节炎[24]:
- ACPA阳性者为63%;
- RF阳性者为53%;
- 抗CarP抗体阳性者为50%。
考虑到ACPA和RF的组合[24]:
- ACPA阴性/RF阳性者为38%;
- ACPA阳性/RF阴性者为50%;
- ACPA阳性/RF阳性者为67%。
也就是说,ACPA阳性/RF阳性患者中,33%的患者在两年内未发展为临床关节炎。
如以自身抗体阴性者转变为临床关节炎的风险为基准,则[24]:
- ACPA阴性/RF阳性者转变为临床关节炎的相对风险是2.6倍(1.04-6.6);
- ACPA阳性/RF阴性的相对风险是为8.0倍(2.4-27.4);
- ACPA阳性/RF阳性的相对风险是为10.5倍(5.4-20.6)。
很显然,如果不是普遍性筛查自身抗体,而是基于临床症状等信息来“选择性检测自身抗体”,那么抗体阳性的预测价值要高得多:
- 无选择的普筛ACPA阳性的22.44%是RA(追踪2年后增加到24.94%)[21];
- 特定人群检测ACPA阳性,预告50%将进展为临床关节炎[24];
- 特定人群ACPA+RF双阳性,预告67%将进展为临床关节炎[24]。
当然,两个研究都只追踪了2年,更长时间的结果可能会不一样。但也说明了一点,诊断RA时,必须选择合适的检测对象。否则,单纯的抗体检测阳性的预测价值不高。
2,如何检测ACPA
尽管检测ACPA的方法细节不是临床医生所必须掌握的知识,但风湿科临床医生向临床化学家学习一些也是有帮助的。
通常来说,很多医院/临床化验中心会选择商业化的体外诊断试剂盒来做检测。然而,很多商业化诊断试剂的检测质量并不那么让人放心[25]。采用国际认可的标准化底物等实现检测标准化是必要的。
主流的检测方法是ELISA法。它是基于抗原-抗体的特异性结合,利用酶标记技术将免疫反应转化为可视信号。酶催化底物显色,通过测量吸光度(OD值)定量目标物浓度,该方法灵敏度高。
目前也开发了一些替代方法,比如电化学发光法、颗粒比浊法、血凝法[26],但这些新方法更多是为资源相对匮乏环境而准备的。
经典的ELISA法检测时,选择什么样的蛋白/肽做标底抗原是关键性的。第一代的标底是瓜氨酸化的丝聚蛋白,通过两个半胱氨酸残基中的巯基之间的氧化折叠,使公共肽序列成为环状的,以便ACPA更有效地识别瓜氨酸化表位。因此,该抗原被表示为环瓜氨酸肽(CCP)[27-28]。
通过使用RA血清从蛋白质库中筛选约1200万条肽,将一组新的肽掺入表示为环瓜氨酸肽版本2(CCP2)的测定中[29]。与抗CCP1相比,抗CCP2在同等特异性下具有更高的诊断敏感性,并且还可定义更多放射学预后不良的患者[30]。
还有一家商业公司开发了自己的环化肽,称为CCP3[31]。目前认为它的敏感性似乎更好,但特异性相对下降。
针对瓜氨酸肽的筛选还在继续,比如基于重组瓜氨酸大鼠丝聚蛋白[32]、基于Epstein-Barr病毒编码蛋白的病毒瓜氨酸肽(VCP2)[33],但它们似乎都没有更好的临床价值。
大多数商业ACPA检测都测量IgG-ACPA,但一些公司开发了主要用于研究目的的商业IgA和IgM-ACPA检测[34-35]。在RA病人中,IgA-ACPA主要与IgG-ACPA同时被检测出来,但的确有部分IgG-ACPA阴性的RA患者中被发现有IgA-ACPA[36-37]。
但IgA-ACPA能否增加额外价值,还不确定。部分研究提示,检测IgA-ACPA能帮助更早诊断RA,以及提示疾病活动性[36-37];但这仍存有争议[38]。
有些研究检测了唾液里的IgA-ACPA(而非血清IgA-ACPA)。尽管唾液IgA-ACPA的阳性率低于血清检测,但唾液IgA-ACPA似乎更能反馈疾病的高活动性(与较高的红细胞沉降率[ESR]、28关节疾病活动评分、压痛关节计数、采样时的患者整体评估相关)[39]。
总 结
现在可以肯定,RA最重要的自身抗体是ACPA,而非RF。无论是预测RA的发生,还是在RA诊断时,ACPA的价值都远高于RF。
虽然学界还有争议,但越来越多学者希望在后续的RA诊断分类标准里,增加ACPA的权重,而降低RF的权重。而选择合适的检测对象,正确的检测方式等,才能最大程度发挥ACPA检测价值。
往期回顾:
2. 如何看待类风湿关节炎的“诊断分类标准”------“标准还要如何修改”?
参考文献(上下滑动查看):
[1] Waaler E. On the occurrence of a factor in human serum activating the specific agglutination of sheep blood corpuscles. Acta Pathologica Microbiologica Scandinavica. 1940;17(2):172–188. doi: 10.1111/j.1600-0463.2007.apm_682a.x.
[2] Rose HM, Ragan C, et al. Differential agglutination of normal and sensitized sheep erythrocytes by sera of patients with rheumatoid arthritis. Proceedings of the Society for Experimental Biology and Medicine. 1948;68(1):1–6. doi: 10.3181/00379727-68-16375.
[3] Pike RM, Sulkin SE, Coggeshall HC. Serological reactions in rheumatoid arthritis; factors affecting the agglutination of sensitized sheep erythrocytes in rheumatid-arthritis serum. Journal of Immunology. 1949;63(4):441–446.
[4] Schellekens GA, de Jong BA, van den Hoogen FH, et al. Citrulline is an essential constituent of antigenic determinants recognized by rheumatoid arthritis-specific autoantibodies. J Clin Invest. 1998;101:273–281. doi: 10.1172/JCI1316.
[5] Koga Y, Ohtake R. Study report of the constituents of squeezed watermelon. J Tokyo Chem Soc. 1914;35:519–528.
[6] Rogers GE, Simmonds DH. Content of citrulline and other amino-acids in a protein of hair follicles. Nature. 1958;182:186–187. doi: 10.1038/182186a0.
[7] Rogers GE. Occurrence of citrulline in proteins. Nature. 1962;194:1149–1151. doi: 10.1038/1941149a0.
[8] Rogers GE, Harding HW, Llewellyn-Smith IJ. The origin of citrulline-containing proteins in the hair follicle and the chemical nature of trichohyalin, an intracellular precursor. Biochim Biophys Acta. 1977;495:159–175. doi: 10.1016/0005-2795(77)90250-1.
[9] Fujisaki M, Sugawara K. Properties of peptidylarginine deiminase from the epidermis of newborn rats. J Biochem. 1981;89:257–263. doi: 10.1093/oxfordjournals.jbchem.a133189.
[10] Pollak VE, Mandema E, Kark RM. Antinuclear factors in the serum of relatives of patients with systemic lupus erythematosus. Lancet.1960;2:1061–1063.
[11] Mandema E, Pollak VE, Kark RM, Rezaian J. Quantitative observations on antinuclear factors in systemic lupus erythematosus. J Lab Clin Med.1961;58:337–352.
[12] Hazenberg BP, Gruys E, van Rijswijk MH. In memoriam Enno Mandema, MD (1921–2010). Amyloid-Journal of Protein Folding Disorders.2011;18:249–250.
[13] Nienhuis RL, Mandema E. A New Serum Factor in Patients with Rheumatoid Arthritis; The Antiperinuclear Factor. Ann Rheum Dis.1964;23:302–305.
[14] Young BJ, Mallya RK, Leslie RD, Clark CJ, Hamblin TJ. Anti-keratin antibodies in rheumatoid arthritis. Br Med J.1979;2:97–99.
[15] Simon M, Girbal E, Sebbag M, et al. The cytokeratin filament-aggregating protein fillagrin is the target of the co-called “antikeratin antibodies,” autoantibodies specific for rheumatoid arthritis. J Clin Invest.1993;92:1387–1393.
[16] Sebbag M, Simon M, Vincent C, et al. The antiperinuclear factor and the so-called antikeratin antibodies are the same rheumatoid arthritis-specific autoantibodies. J Clin Invest.1995;95:2672–2679.
[17] Steiner G, Van Hoovels L, Csige D, et al. Should ACR/EULAR criteria be revised changing the RF and ACPA scores. Autoimmun Rev 2024;23:103421. 10.1016/j.autrev.2023.103421
[18] Guenter Steiner, Patrick Verschueren, Lieve Van Hoovels,et al. Classification of rheumatoid arthritis: is it time to revise the criteria? RMD Open. 2024 Apr 19;10(2):e003851. doi:External, opens in a new tab.10.1136/rmdopen-2023-003851
[19] Nielen M.M., van Schaardenburg D., Dijkmans B.A,et al. Specific autoantibodies precede the symptoms of rheumatoid arthritis: A study of serial measurements in blood donors. Arthritis Rheumatol. 2004;50:380–386. doi: 10.1002/art.20018.
[20] van Zanten A, Arends S, Roozendaal C, et al. Presence of anticitrullinated protein antibodies in a large population-based cohort from The Netherlands. Ann Rheum Dis 2017; 76: 1184–1190. DOI: 10.1136/annrheumdis-2016-209991.
[21] Westra J, Brouwer E, Raveling-Eelsing E, et al. Arthritis autoantibodies in individuals without rheumatoid arthritis: follow-up data from a Dutch population-based cohort (Lifelines). Rheumatology (Oxford) 2021; 60: 658–666. DOI: 10.1093/rheumatology/keaa219.
[22] 类风湿关节炎的发病机制,Uptodate临床顾问
[23] Eui-Jong Kwon , Ji Hyeon Ju . Impact of Posttranslational Modification in Pathogenesis of Rheumatoid Arthritis: Focusing on Citrullination, Carbamylation, and Acetylation . Int J Mol Sci. 2021 Sep 30;22(19):10576. doi:10.3390/ijms221910576
[24] RM Ten Brinck , HW Van Steenbergen , MAM Van Delft , et al. The risk of individual autoantibodies, autoantibody combinations and levels for arthritis development in Clinically Suspect Arthralgia . Rheumatology (Oxford). 2017 Dec 1;56(12):2145–2153. doi: 10.1093/rheumatology/kex340
[25] Lieve Van Hoovels , Bert Vander Cruyssen , Xavier Bossuyt , et al. Multicentre study to improve clinical interpretation of rheumatoid factor and anti-citrullinated protein/peptide antibodies test results . RMD Open. 2022 Mar 23;8(1):e002099. doi:10.1136/rmdopen-2021-002099
[26] Ilmar Kruis , Jyoti Kumari , Ger J M Pruijn ,et al. Anti-citrullinated protein antibody detection by hemagglutination .Rheumatol Adv Pract. 2025 Jan 20;9(1):rkaf010. doi:10.1093/rap/rkaf010
[27] Simon M, Girbal E, Sebbag M, Salama G, et al. The Cytokeratin Filament-Aggregating Protein Filaggrin is the Target of the So-Called “Antikeratin Antibodies,” Autoantibodies Specific for Rheumatoid Arthritis. J Clin Invest (1993) 92(3):1387–93. 10.1172/JCI116713
[28] Schellekens GA, Visser H, de Jong BA, van den Hoogen FH, et al. The Diagnostic Properties of Rheumatoid Arthritis Antibodies Recognizing a Cyclic Citrullinated Peptide. Arthritis Rheum (2000) 43(1):155–63.
[29] van Venrooij WJ, van Beers JJ, Pruijn GJ. Anti-CCP Antibodies: The Past, the Present and the Future. Nat Rev Rheumatol (2011) 7(7):391–8. 10.1038/nrrheum.2011.76
[30] van Gaalen FA, Visser H, Huizinga TW. A Comparison of the Diagnostic Accuracy and Prognostic Value of the First and Second Anti-Cyclic Citrullinated Peptides (CCP1 and CCP2) Autoantibody Tests for Rheumatoid Arthritis. Ann Rheum Dis (2005) 64(10):1510–2. 10.1136/ard.2004.035089
[31] Swart A, Burlingame RW, Gurtler I, Mahler M. Third Generation Anti-Citrullinated Peptide Antibody Assay is a Sensitive Marker in Rheumatoid Factor Negative Rheumatoid Arthritis. Clin Chim Acta (2012) 414:266–72. 10.1016/j.cca.2012.09.015
[32] Bizzaro N, Tampoia M. Diagnostic Accuracy of Immunoassays for the Detection of Antibodies to Citrullinated Proteins. Clin Rev Allergy Immunol (2008) 34(1):16–20. 10.1007/s12016-007-8027-0
[33] Bizzaro N, Allegri F, Lotzniker M, et al. Multicentric Evaluation of a Second Generation Assay to Detect Antiviral Citrullinated Peptide Antibodies: A Collaborative Study by the Forum Interdisciplinare Per La Ricerca Nelle Malattie Autoimmuni. J Clin Pathol (2011) 64(12):1139–41. 10.1136/jclinpath-2011-200308
[34] Ärlestig L, Mullazehi M, Kokkonen H, Rocklöv J, Rönnelid J, Dahlqvist SR. Antibodies Against Cyclic Citrullinated Peptides of IgG, Iga and IgM Isotype and Rheumatoid Factor of IgM and IgA Isotype are Increased in Unaffected Members of Multicase Rheumatoid Arthritis Families From Northern Sweden. Ann Rheum Dis (2012) 71(6):825–9. 10.1136/annrheumdis-2011-200668
[35] Svärd A, Skogh T, Alfredsson L, et al. Associations With Smoking and Shared Epitope Differ Between IgA- and IgG-class Antibodies to Cyclic Citrullinated Peptides in Early Rheumatoid Arthritis. Arthritis Rheumatol (2015) 67(8):2032–7. 10.1002/art.39170
[36] Sieghart D, Platzer A, Swiniarski S, et al. Determination of autoantibody isotypes increases the sensitivity of serodiagnostics in rheumatoid arthritis. Front Immunol. 2018;9:876.
[37] Sokolova MV, Hagen M, Bang H, Schett G, Rech J, Steffen U, et al. IgA anti-citrullinated protein antibodies are associated with flares during DMARD tapering in rheumatoid arthritis. Rheumatology (Oxford). 2022;61(5):2124–31.
[38] Judith W Heutz , Agnes E M Looijen , Jac H S A M Kuijpers , et al. The prognostic value of IgA anti-citrullinated protein antibodies and rheumatoid factor in an early arthritis population with a treat-to-target approach .Immunol Res. 2024 Jul 3;72(5):982–990. doi:10.1007/s12026-024-09500-w
[39] Roos Ljungberg K, Börjesson E, Martinsson K, Wetterö J, Kastbom A, Svärd A. Presence of salivary IgA anti-citrullinated protein antibodies associate with higher disease activity in patients with rheumatoid arthritis. Arthritis Res Ther. 2020;22(1):274.















































