20+的Nature子刊文章,也有逻辑漏洞?读文献学习科研思维和课题设计!实战篇7
已发表的文献千千万,并非都是完美无瑕,包括20+的Nature子刊上发表的文章,依然可能存在逻辑漏洞,今天大师兄带你一探究竟!【本文较长,可能占据5-10分钟】

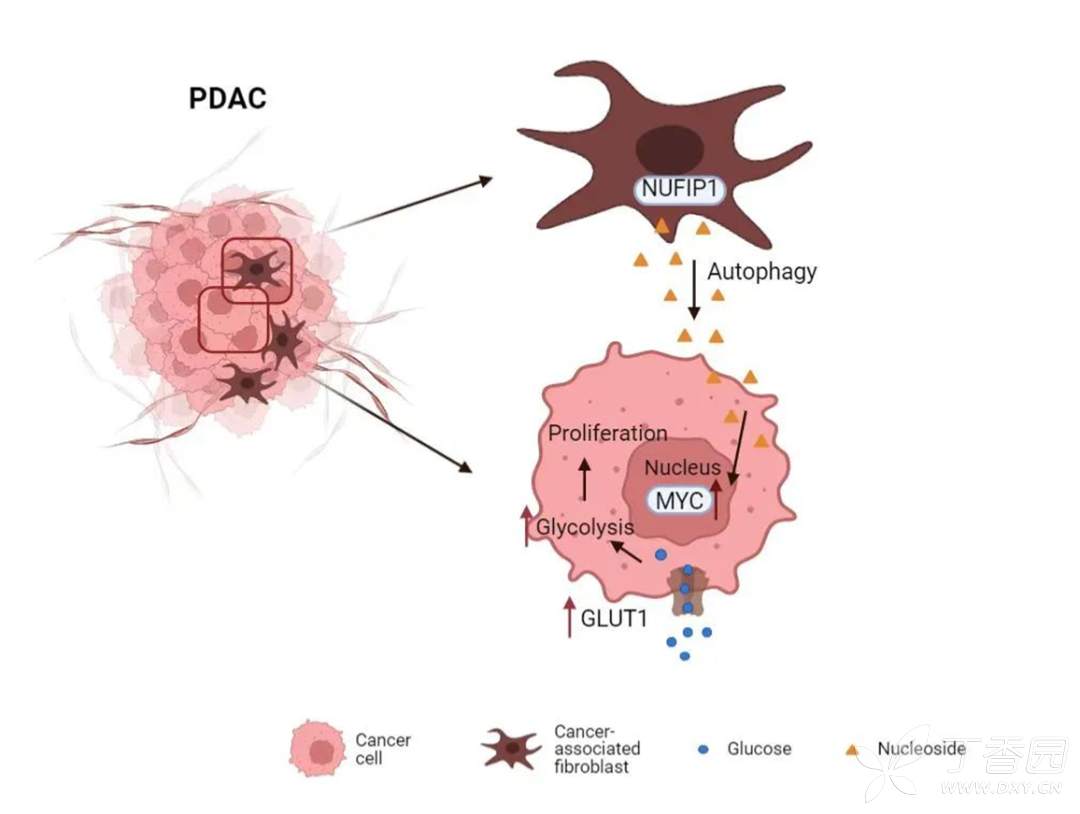
今天跟大家分享一篇上周(2022.8.18)发表在Nature cancer上的关于CAF通过NUFIP1介导的核糖体自噬分泌核苷促进胰腺癌肿瘤细胞生长的研究论文,通讯作者是来北京大学基础医学院的的赵颖教授。
摘要
肿瘤相关纤维细胞CAF是胰腺癌肿瘤微环境中的主要组分。本研究发现CAF对于谷氨酰胺(Gln)缺乏条件下胰腺癌肿瘤细胞的生存维持至关重要。机制上,本研究揭示,Gln缺乏时,激活CAF发生NUFIP1介导的核糖体自噬,促进胰腺癌细胞中MYC表达,增强葡萄糖代谢相关基因表达,进而对葡萄糖摄取及利用,促进肿瘤细胞增殖。利用CAF条件性敲除小鼠模型,进行胰腺癌原位成瘤实验,证实了,靶向NUFIP1可以抑制肿瘤生长。本研究创新性的揭示了CAF中核糖体自噬通过核苷影响肿瘤细胞糖代谢这一调控网络。
研究背景
- CAF是胰腺癌肿瘤微环境中主要成分,CAF的细胞来源多种多样。
- 之前研究发现自噬主要是非选择性自噬,最近研究发现也存在选择性自噬。选择性自噬是指,特定细胞器(主要包括核糖体、线粒体、内质网等)通过其表面特异性受体结合自噬相关蛋白ATG11,启动自噬过程,诱导特定细胞器发生自噬。
非选择自噬模式:
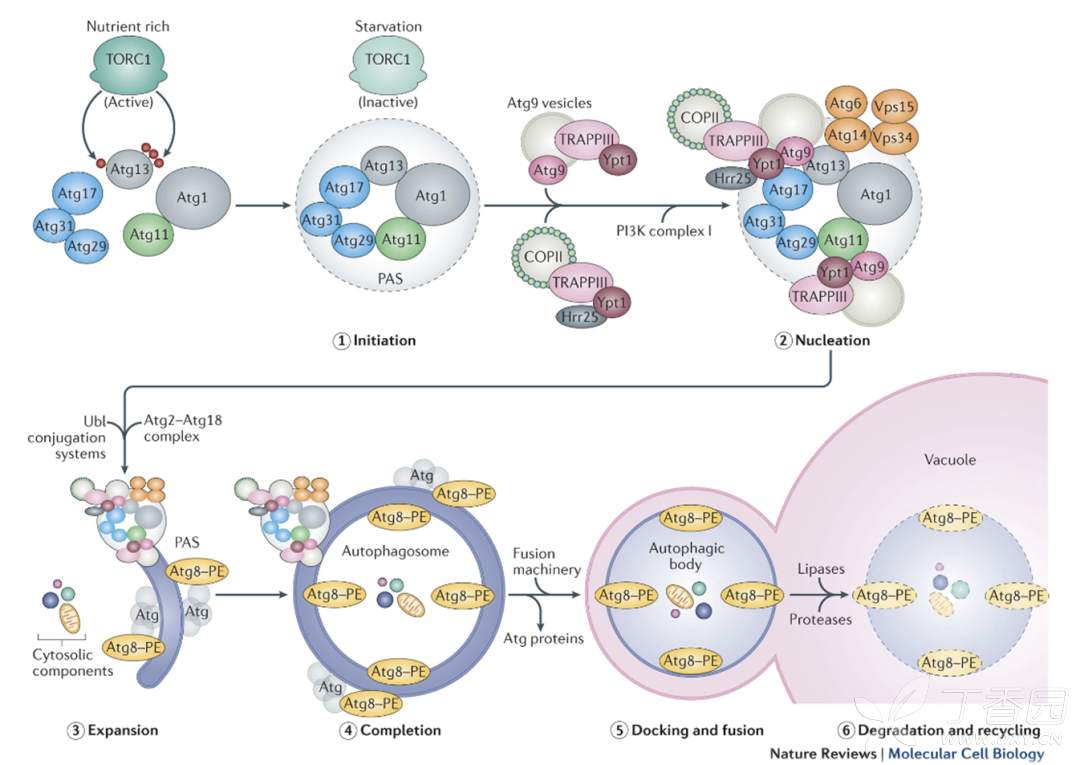
选择性自噬模式:
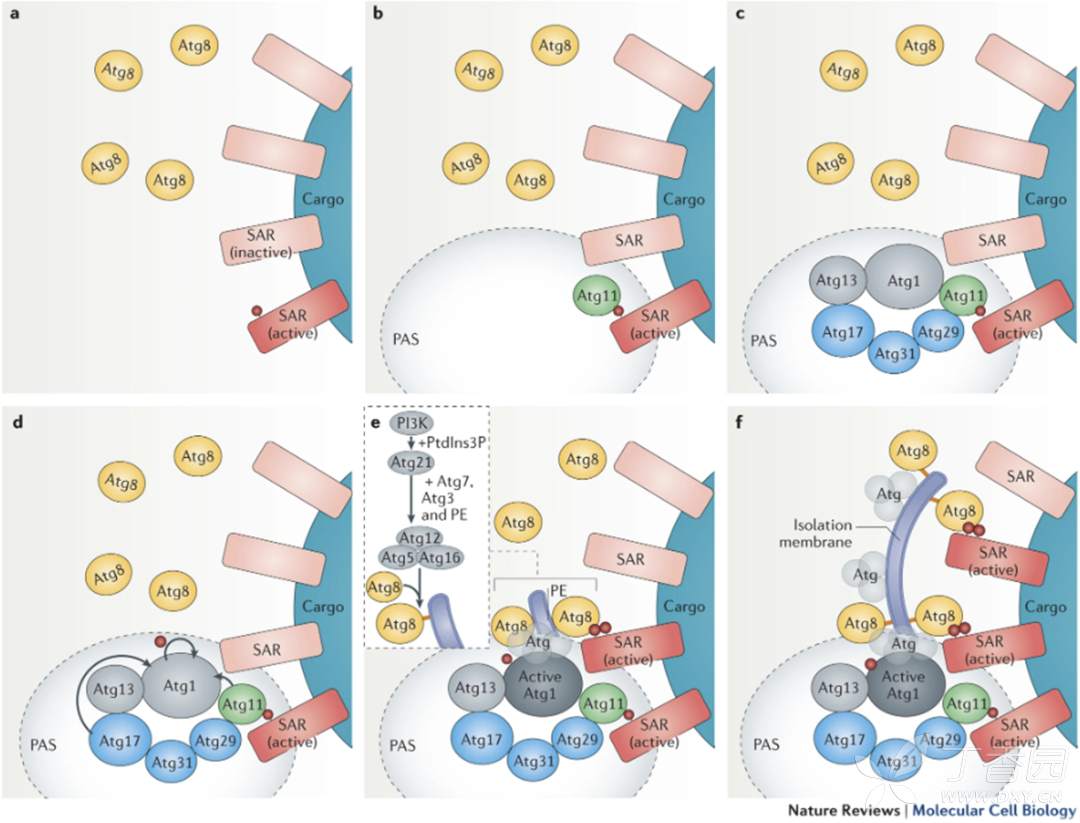
- 本研究涉及的是CAF的核糖体选择性自噬。2018年一篇SCIENCE发现,核糖体选择性自噬ribophagy由NUFIP1介导,结果是降解核糖体RNA,产生大量核苷。

- 另外,相当多的研究证实,CAF非选择性自噬可以通过分泌细胞因子、代谢物等多种途径促进肿瘤增殖、转移、干性等恶性表型。然而CAF中是否有哪种选择性自噬在肿瘤中发挥作用尚未可知,这也是该研究主要的创新性切入点。
研究结果
1.谷氨酰胺缺乏下,CAF通过NUFIP1介导的核糖体自噬促进胰腺癌增殖
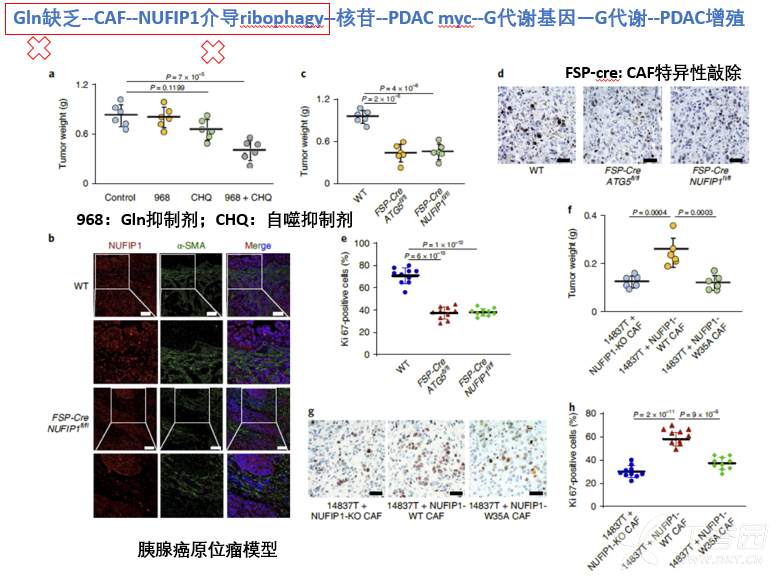
Gln(谷氨酰胺)和Glu(葡萄糖)是肿瘤细胞增殖的主要碳源,然而本研究检测胰腺癌原位瘤组织微环境中Gln(谷氨酰胺)和Glu(葡萄糖)含量,发现肿瘤微环境中Gln和Glu都有显著下调,处于Gln缺乏状态。为了探究Gln缺乏状态对胰腺癌细胞增殖影响,本研究进行了体外和体内两部分实验。体外通过Gln剥夺和Gln抑制剂(968)证实,Gln缺乏可以显著抑制胰腺癌肿瘤细胞增殖能力。然而,体内通过968抑制谷氨酰胺代谢,对胰腺癌肿瘤增殖无影响。体外、体内这种结果差异提示,肿瘤微环境中存在某种中介,导致肿瘤细胞对体内Gln缺乏情况下的耐受。
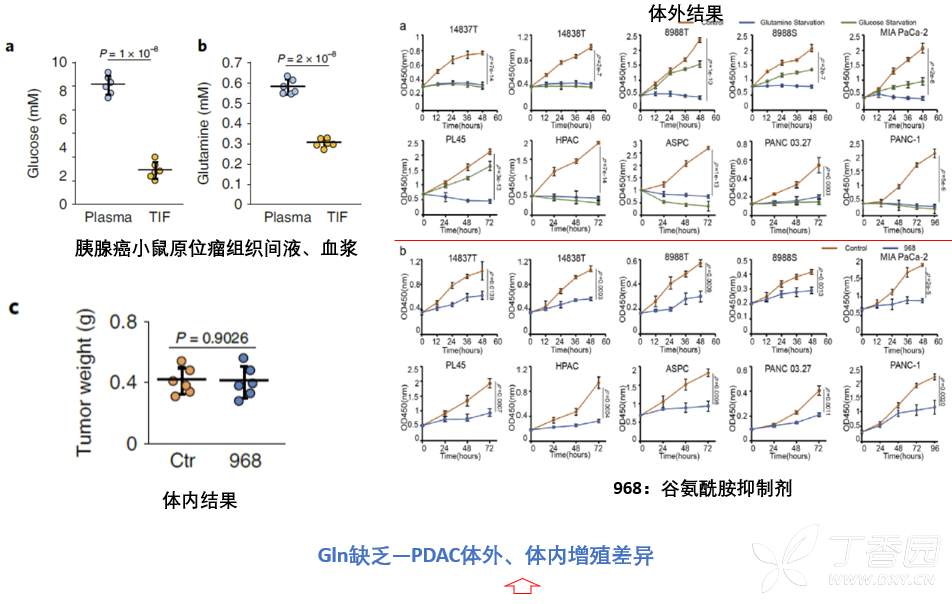
而胰腺癌肿瘤微环境中,CAF是最主要的组分,因此,首先考虑CAF是否介导了Gln缺乏情况下,促进肿瘤细胞增殖?已有研究证实CAF中的自噬,可以促进肿瘤细胞增殖等恶性表型,此处如果还是以CAF自噬对胰腺癌肿瘤细胞的促增殖表型作为研究切入点,便缺乏创新性。考虑到最进研究发现,细胞可以发生选择性自噬(主要包括核糖体、内质网、线粒体),因此,本研究以此作为切入点,从更细化的选择性自噬作为创新性切入点,筛选CAF通过哪种选择性自噬促进肿瘤细胞对Gln缺乏的耐受。为此,本研究构建了针对非选择性自噬分子ATG3/5、核糖体选择性自噬分子NUFIP1、内质网选择性自噬分子Sec24c、线粒体选择性自噬受体Parkin的敲除CAF细胞株,然后利用Gln缺乏培养基培养这些CAF,再用这些CAF条件培养基CM处理Gln缺乏的胰腺癌细胞。结果发现,正常CAF条件培养基确实可以促进胰腺癌细胞在Gln缺乏下的增殖,阻断CAF非特异性自噬后,则CM不能促进肿瘤细胞在Gln缺乏下的增殖,这与之前研究结果一致,作为阳性对照。同时发现,只有特异性阻断CAF中NUFIP1介导的核糖体自噬,才能阻断CAF CM对肿瘤细胞的促增殖作用。以上结果表明,在Gln缺乏下,CAF通过NUFIP1介导的核糖体自噬促进肿瘤细胞增殖。
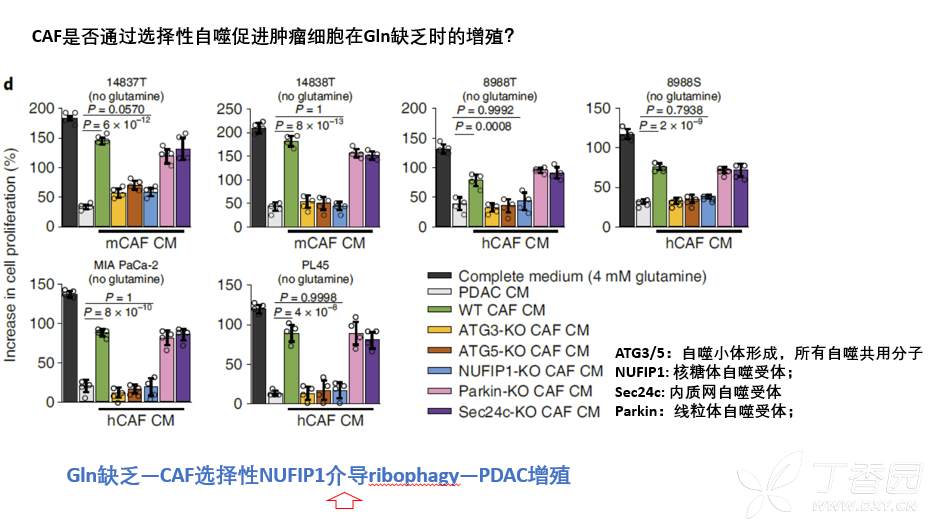
2.谷氨酰胺缺乏下,CAF通过核糖体自噬促进rRNA降解
接下来问题是,Gln缺乏下,CAF如何通过核糖体自噬促进肿瘤细胞增殖?
文献已经报道,核糖体自噬可以通过降解核糖体RNA,促进生成大量核苷。所以提出猜想,Gln缺乏通过诱导CAF核糖体自噬,促进核糖体RNA降解,产生核苷促进胰腺癌细胞增殖。
为证实此猜想,首先要证明Gln缺乏通过诱导CAF核糖体自噬导致核糖体RNA(rRNA)降解?实验结果表明,Gln缺乏下,CAF可以通过核糖体自噬促进rRNA降解,而不影响核糖体蛋白降解。
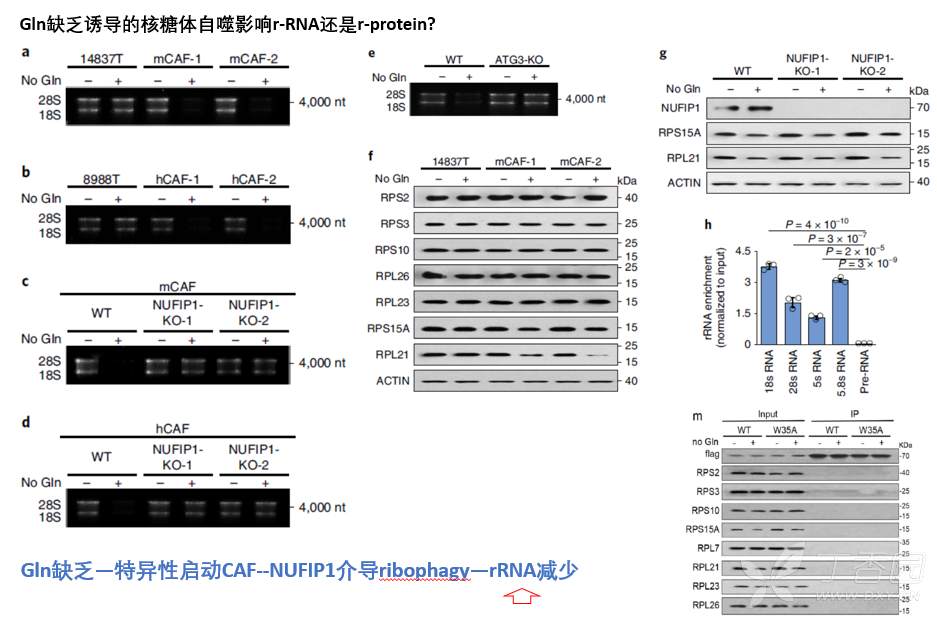
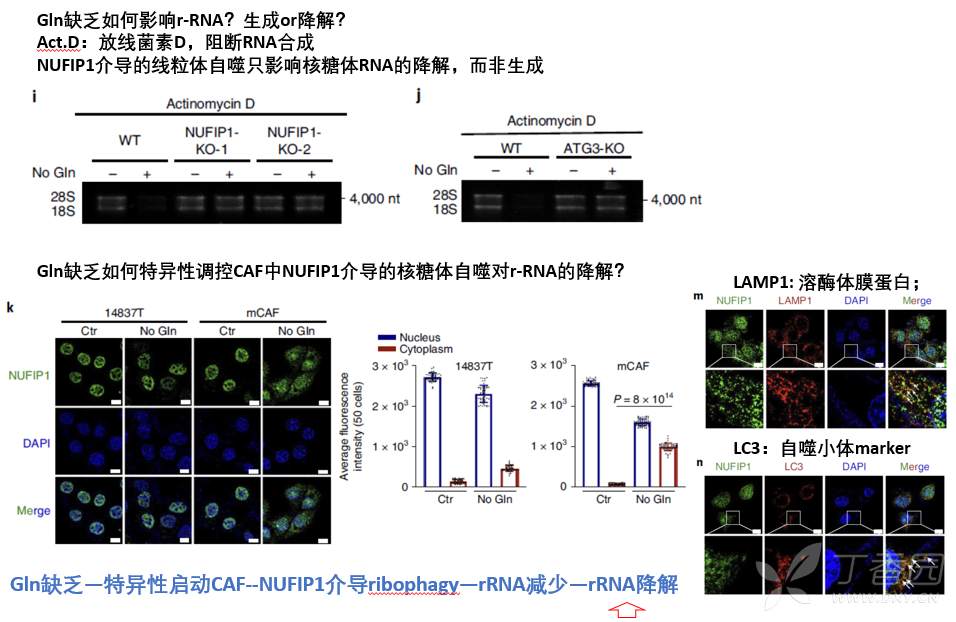
3.谷氨酰胺缺乏下,CAF通过核糖体自噬促进rRNA降解生成核苷促进胰腺癌细胞增殖
接着继续证实猜想:Gln缺乏通过诱导CAF核糖体自噬,促进核糖体RNA降解,产生核苷促进胰腺癌细胞增殖。
为此需要证实以下三点:
1.Gln缺乏时,CAF核糖体自噬可以产生、分泌核苷;
2.CAF来源的核苷可以被肿瘤细胞摄取;
3.核苷被肿瘤细胞摄取后可以促进肿瘤细胞增殖。
于是,该研究开展了三方面实验,分别进行了证实。
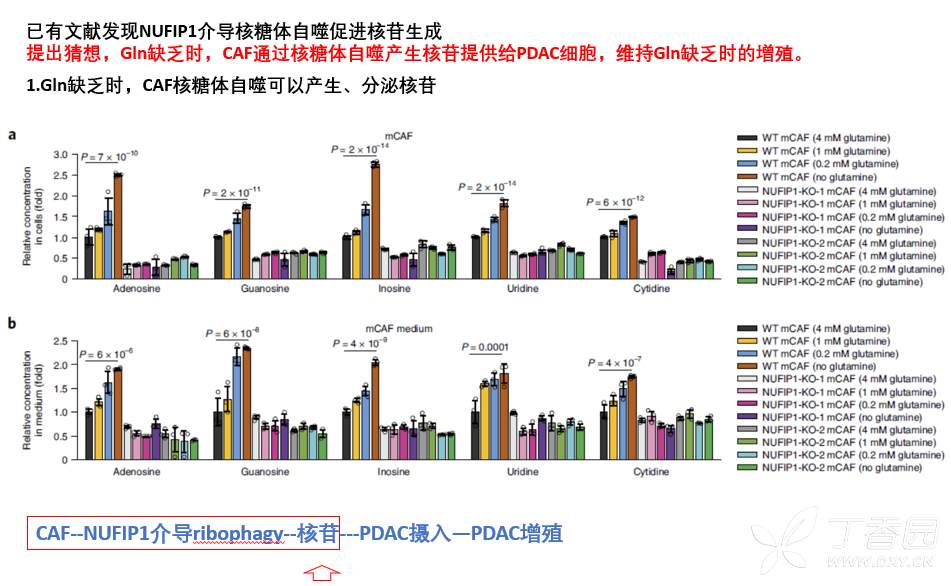
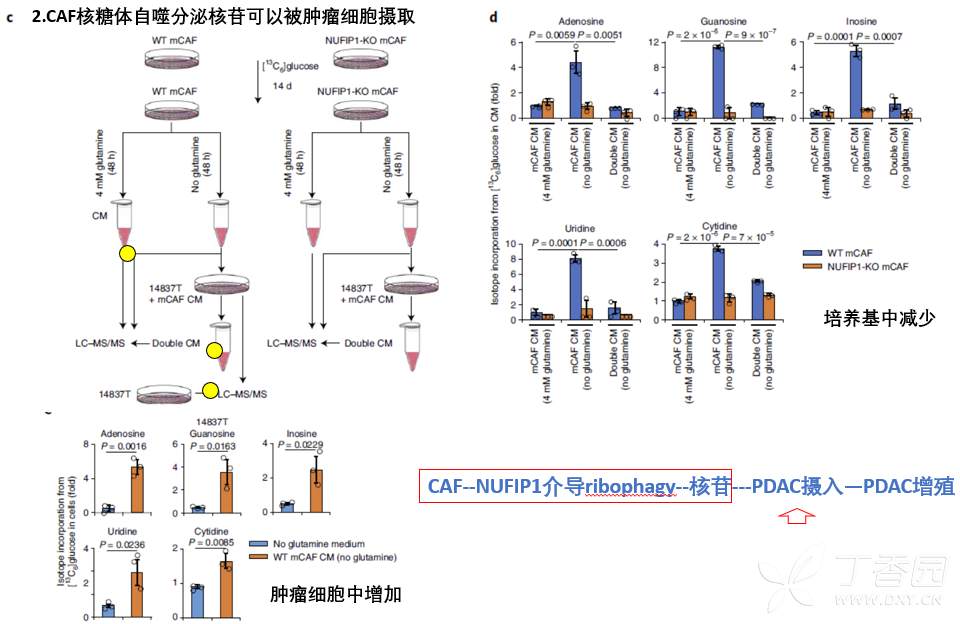
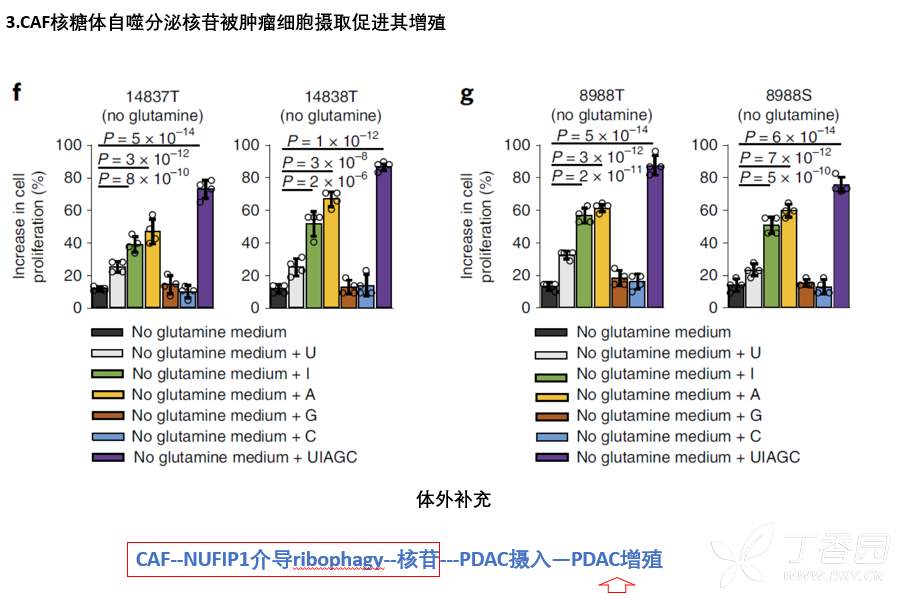
4.Gln缺乏下,CAF通过核糖体自噬分泌核苷促进肿瘤细胞代谢进而促进增殖。
接着,需要继续探究CAF来源核苷,进入肿瘤细胞中如何被肿瘤细胞代谢,进而促增殖?
为此,本研究检测了摄取核苷后肿瘤细胞内代谢改变,发现肿瘤细胞内核苷水平明显增加,且参与葡萄糖代谢的产物,包括葡萄糖都有显著增加,并且可以显著增强肿瘤细胞有氧氧化过程。
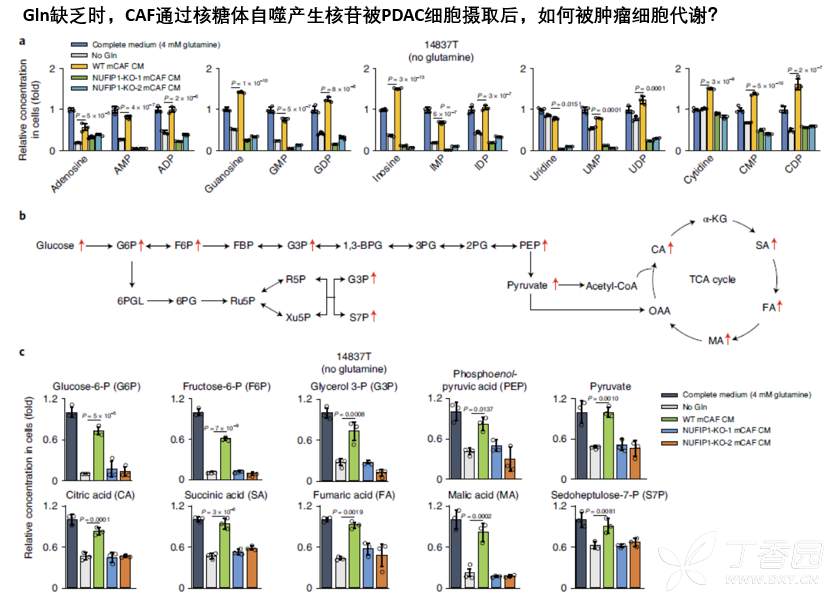
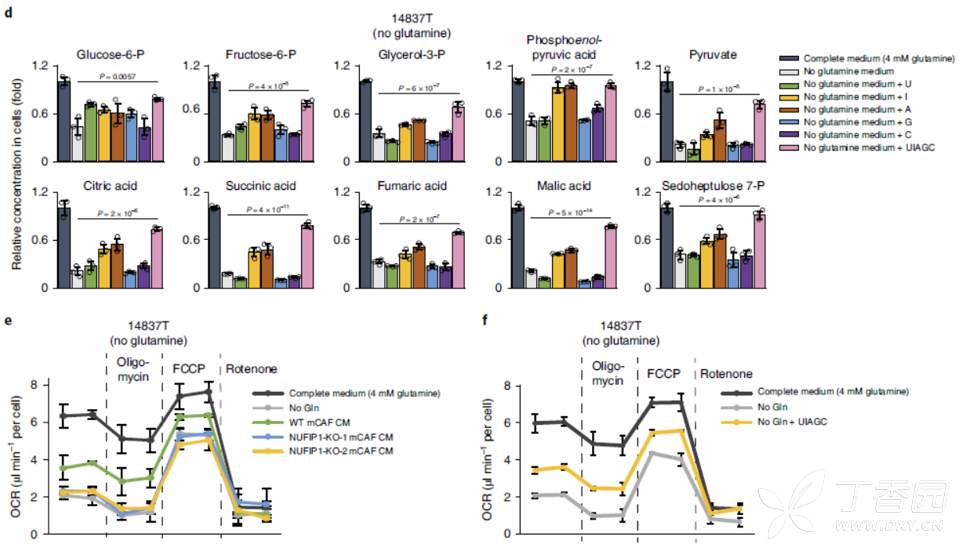
那么核苷是否直接作为碳源被肿瘤细胞利用,促进了糖代谢呢?
为此,进行了C13标记核苷同位素示踪,进行质谱检测代谢流,结果表明核苷进入肿瘤细胞后,并未参与肿瘤细胞的TCA循环,说明核苷被肿瘤细胞摄取后并不是作为直接碳源,促进肿瘤细胞糖代谢的。
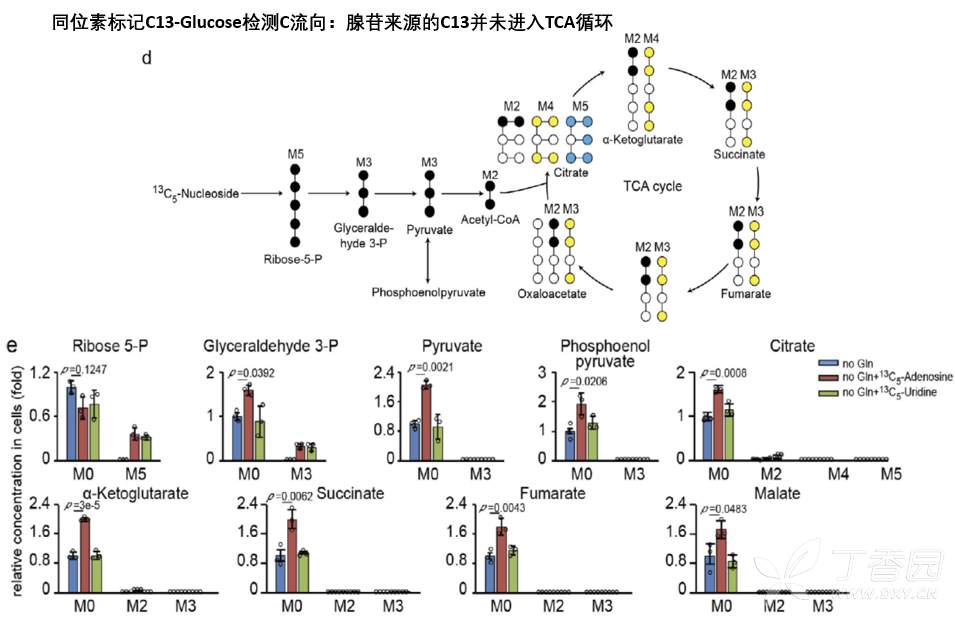
5.腺苷直接促进胰腺癌细胞对葡萄糖的摄取利用
接着,既然腺苷被肿瘤细胞摄取后不能作为直接碳源参与TCA循环,那如何增强肿瘤细胞糖代谢的?
调控糖代谢分为两种层面:1.代谢物水平;2.代谢调控基因表达。
既然核苷不直接作为碳源参与肿瘤细胞糖代谢调控,考虑其最可能通过调控糖代谢基因表达进而增强肿瘤糖代谢。
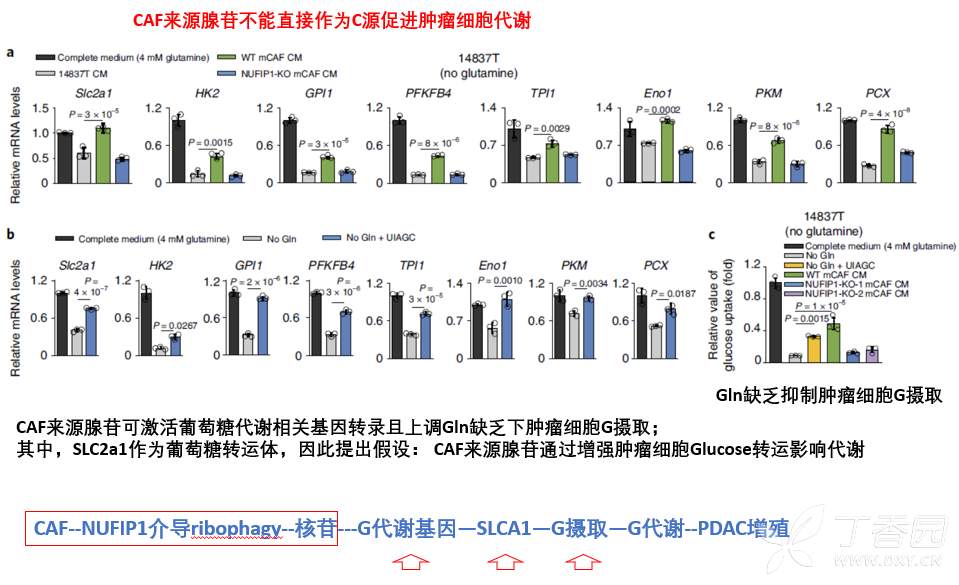
为此,本研究检测了CAF来源核苷处理肿瘤细胞后,对糖代谢相关基因表达影响,发现可以显著上调糖代谢相关基因,包括葡萄糖转运体SLC2A1。同时,上部分结果观察到,核苷进入肿瘤细胞后可以增强细胞中葡萄糖水平。因而,提出以下假设:核苷进入肿瘤细胞后,通过上调肿瘤细胞糖代谢相关基因SLCA1,增强肿瘤细胞对葡萄糖摄取,进而增强糖代谢,促进增殖。
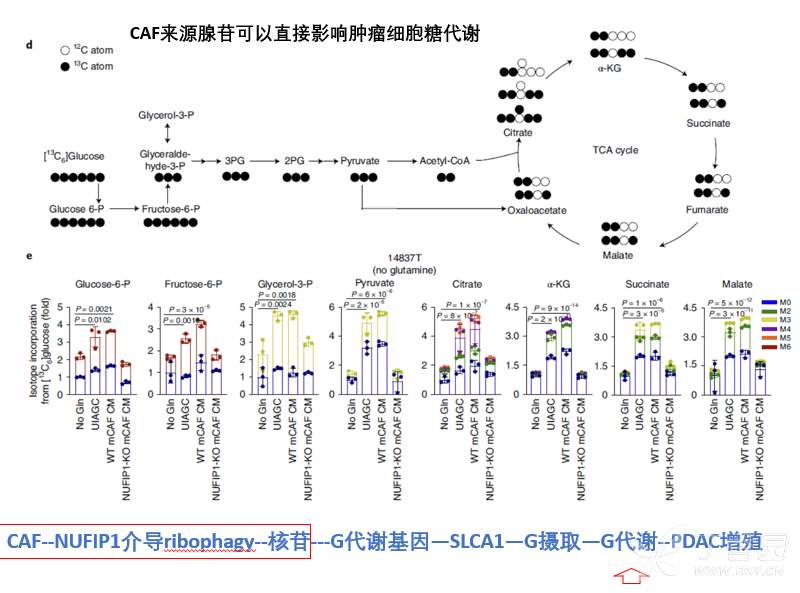
为了进一步证实以上假设,本研究继续利用C13标记葡萄糖,检测在Gln缺乏下,核苷处理肿瘤细胞后,对肿瘤细胞糖代谢影响,发现核苷确实可以显著增强肿瘤细胞糖代谢过程。
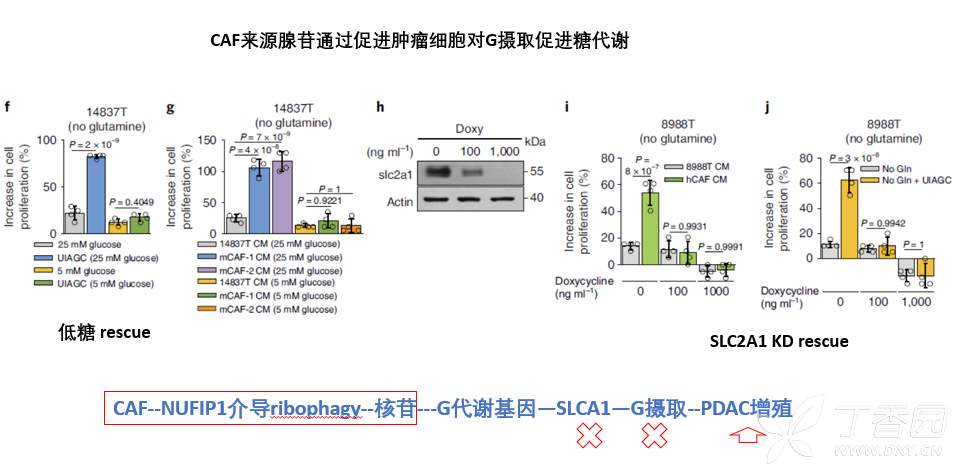
接着为了证实以上假设,进行了rescue实验,通过敲降肿瘤细胞SLC2A1或减少葡萄糖供给,阻断肿瘤细胞对葡萄糖的摄取,结果发现,CAF来源的腺苷就不能发挥促进肿瘤细胞增殖效应(在Gln缺乏条件下)。
通过以上结果证实,Gln缺乏条件下,CAF通过核糖体自噬分泌核苷,被肿瘤细胞摄取后通过上调肿瘤细胞葡萄糖转运体SLCA1,促进葡萄糖摄取,促进增殖。
6.CAF来源核苷通过激活肿瘤细胞MYC表达调控糖代谢基因
接着问题是,CAF来源核苷被肿瘤细胞摄取后,如何上调糖代谢相关基因?
为此,本研究将核苷处理前后的肿瘤细胞(Gln缺乏条件下)进行转录组测序,结果表明核苷被肿瘤细胞摄取后可以显著增MYC基因集表达,而MYC作为糖代谢调控的核心基因。因此可提出假设:CAF来源核苷通过激活肿瘤细胞MYC表达促进糖代谢基因转录。
通过实验证实,阻断肿瘤细胞核苷摄入,可以抑制MYC水平,糖代谢基因表达,同时抑制肿瘤细胞增殖。
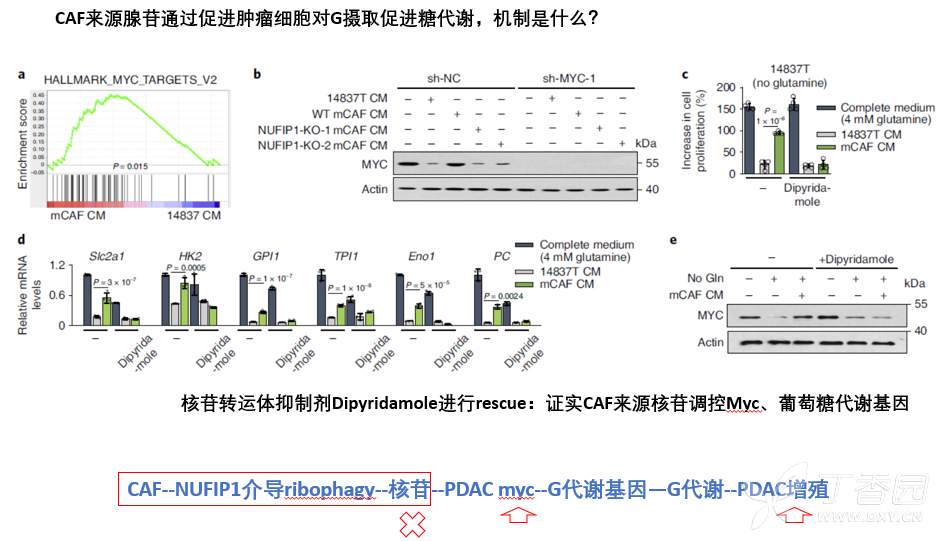
而敲降MYC,也可以阻断核苷对肿瘤糖代谢基因的调控、糖代谢产物。
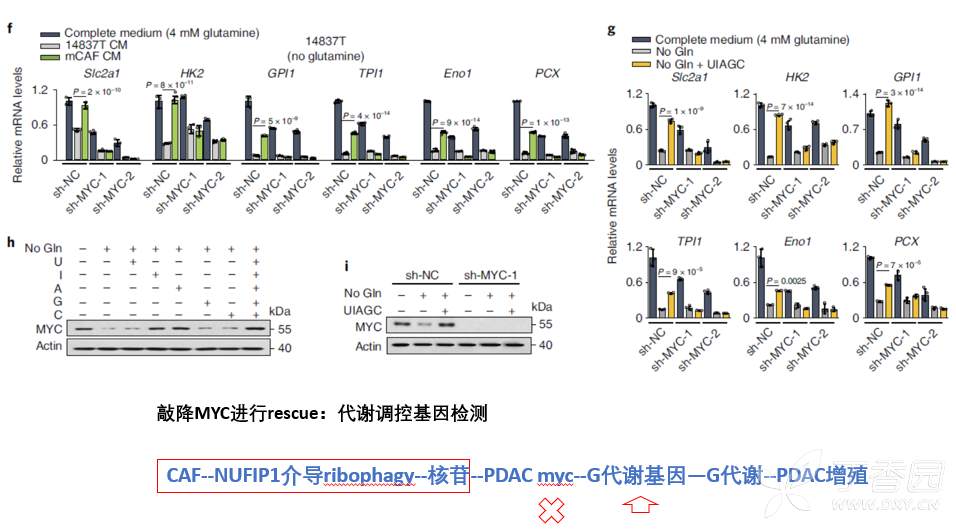
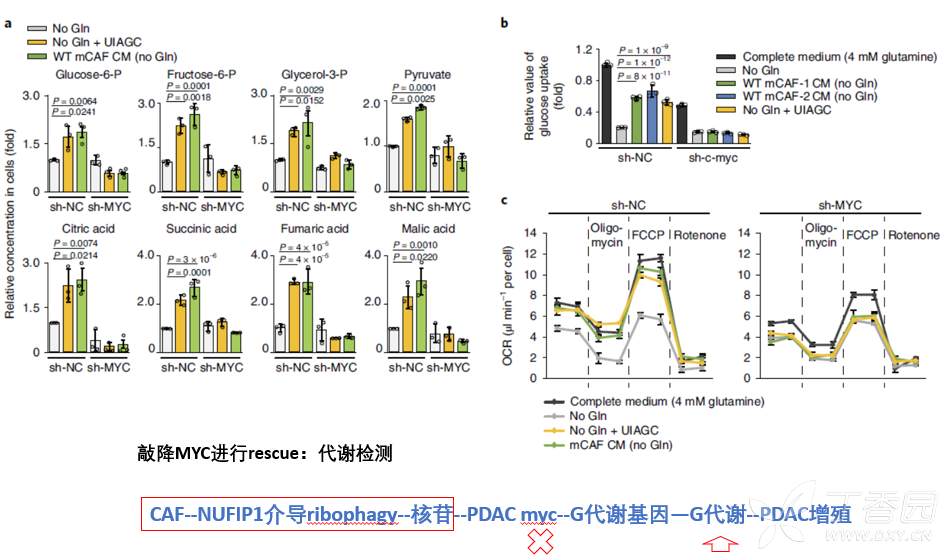
以上结果证实CAF来源核苷进入肿瘤细胞,通过激活MYC,促进糖代谢基因转录,增强糖代谢过程,促进了肿瘤增殖。
接下来问题是,核苷进入肿瘤细胞,如何激活MYC表达?
据文献报道,核苷可以通过结合基因3'-UTR,促进翻译,增强表达。本研究因此提出假设,核苷进入肿瘤细胞后,通过结合MYC3'-UT,促进其翻译,增加表达。并通过以下体外实验实验证实了这一猜测。
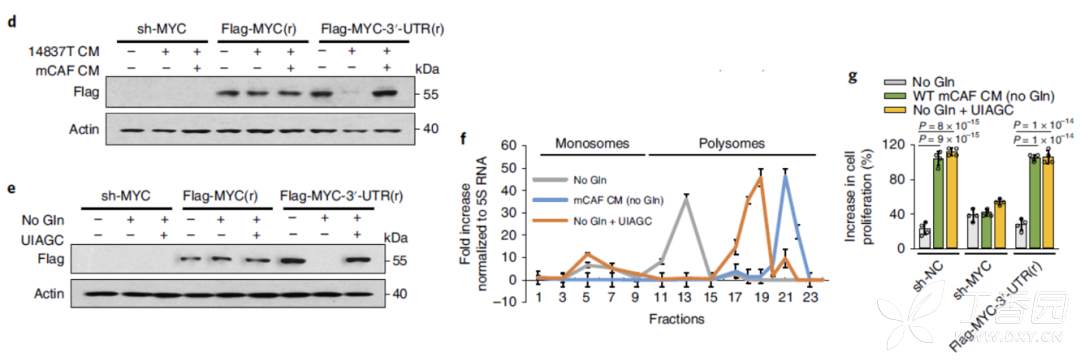
7.体内NUFIP1在PDAC中的作用
基于以上发现,本研究利用Gln抑制剂联合自噬抑制剂,发现可以显著抑制胰腺癌肿瘤生长。并且利用CAF中特异性敲除NUFIP1基因,阻断CAF特异性核糖体自噬,构建胰腺癌原位瘤模型,发现可以显著抑制胰腺癌肿瘤细胞增殖。
全文小结
至此,本研究的表型及机制部分证明完成。提出并证实Gln缺乏条件下,CAF激活NUFIP1以来的核糖体自噬,促进核糖体RNA降解,产生大量核苷分泌到微环境,被肿瘤细胞摄取后,结合到肿瘤细胞MYC mRNA的3'-UTR,促进MYC翻译,并通过MYC上调葡萄糖代谢相关基因促进肿瘤细胞对葡萄糖摄取及代谢过程,最终促进肿瘤细胞增殖。work model(Gln缺乏--CAF--NUFIP1介导ribophagy--核苷--PDAC myc--G代谢基--G代谢--PDAC增殖)
本研究存在问题
总体上,本研究看起来逻辑紧密,层层推进。然而还是存在一点矛盾如下:
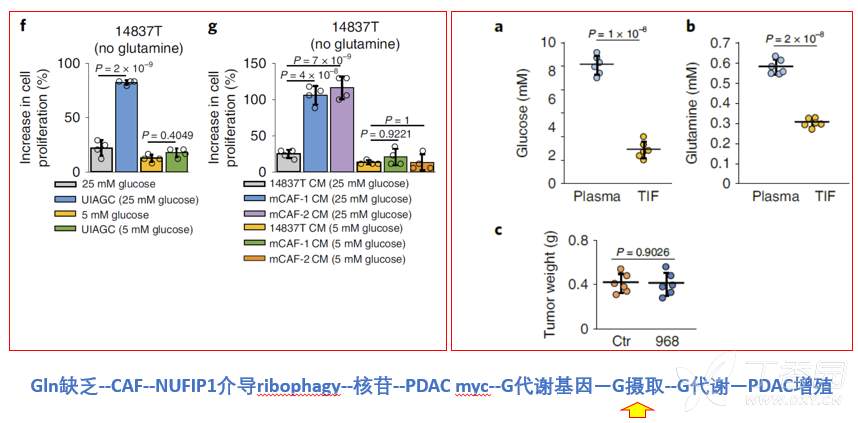
本研究提出Gln缺乏条件下,CAF通过核糖体自噬分泌核苷,促进肿瘤细胞增加对葡萄糖摄取,促进糖代谢,进而促进肿瘤细胞增殖的调控机制。基于此,本研究也发现,在低糖条件下(5mM),CAF来源的核苷并不能促进肿瘤细胞增殖(图f-g)。然而,本研究最初发现胰腺癌肿瘤微环境是低糖条件(葡萄糖3mM)(图a),这意味着,在胰腺癌微环境中CAF并不能通过分泌核苷,促进肿瘤细胞葡萄糖摄取进而促进肿瘤增殖。因此,本研究提出的work model并不能解释最初提出的胰腺癌Gln缺乏环境下,CAF通过分泌核苷促进肿瘤生长的研究假设。这是本研究的最大矛盾点,也是最大的不足之处!
孟子曰:尽信书,则不如无书。
我们针对文献学习不能盲目,应该带着批判的眼光,取其精华,选择性吸收。
希望对大家文献学习和课题逻辑设计有些启发~
















































