G418筛选
G418筛选悬浮细胞
一、G418的性质以及配制方法
性质:G418 :白色粉末,融点138~144℃,溶于水、甲醇。
CAS No.:108321-42-2
分子式 :C20H40N4O10 •2H2SO4 分子量 :692.71
比旋:+104o~+121o 水分:≤10% 吸光值:≤0.015 (280nm,1mg/ml), ≤0.1 (570nm, 100mg/ml)
G418是一种氨基糖类抗生素,其结构与新霉素、庆大霉素、卡那霉素相似,它通过影响80S核糖体功能而阻断蛋白质合成,对原核和真核等细胞都有毒性 ,包括细菌、酵母、植物和哺乳动物细胞 ,也包括原生动物和蠕虫。是稳定转染最常用的选择试剂。当neo基因被整合进真核细胞基因组合适的地方后 ,则能启动neo基因编码的序列转录为mRNA,从而获得抗性产物氨基糖苷磷酸转移酶的高效表达 ,使细胞获得抗性而能在含有G418的选择性培养基中生长。G418的这一选择特性 ,已在基因转移、基因敲除、抗性筛选以及转基因动物等方面得以广泛应用。 G418有杀菌作用, 本身有很好的杀菌效果,在用G418进行筛选的过程中很少会发生污染。
配置:
方案一: 300mgG418加入3ml PBS溶液,浓度为100mg/ml,完全溶解后,0.22um
过滤,-20℃保存。
方案二:(1)配制1M HEPES:23.8g HEPES(缓冲能力更强)粉末溶于100ml ddH2O,10N NaOH(加量较多)调节pH至7.3,过滤除菌(较难过滤),4℃保存,终浓度为1mol/L。
(2)5g G418溶于10ml 1M HEPES(pH7.3),终浓度为500mg/ml,-20℃保存。
注:实验中采用方案二时效果较好。
二、G418筛选稳定表达细胞系实验步骤
1、制备筛选培养基:用培养基将G418稀释为0 ug/ml 、200 ug/ml 、300 ug/ml 、400 ug/ml、500 ug/ml 、600 ug/ml 、700 ug/ml 、800 ug/ml、900ug/ml、1000ug/ml、1100ug/ml、1200ug/ml
24孔板,每孔1ml培养基(含有G418的完全培养基),每个浓度4个重复,则每次换液需各个浓度培养基4ml,现用现配。
2、细胞培养:将冻存的细胞复苏培养,传代3至4次使细胞达到良好的生长状态,铺24孔板(20000/孔),12h换液,加筛选培养基培养。
3、确定G418最佳筛选浓度:将培养孔中培养基吸除,PBS洗涤一次,每孔加入不同浓度筛选培养基,隔天更换一次筛选培养基,培养10-14天,以最低细胞全部死亡浓度为基准。在第一轮就筛选出最佳G418浓度的可能性不大,最有可能的是出现这种情况:用某一浓度G418的量在筛选14天后还不能杀死细胞,而用下一个梯度的 G418的量在10天前就看不到活细胞了。假如是400ug/ml不能杀死细胞,而800ug/ml在第5天就把所有细胞都杀死了,则可以再用500ug/ml、600ug/ml、700ug/ml进一步筛选,以确定最佳筛选浓度!心得:由于特性明确的细胞系G418的最佳用量还是比较稳定的,所以有时候不需要在这么大范围内进行筛选。比如说你要转染NIH3T3细胞 ,现在我告诉你我测试过NIH3T3细胞对G418的敏感性,我用的筛选浓度是200 ug/ml。这时你就可以做150ug/ml、200ug/ml、 300ug/ml三个浓度进行筛选。
筛选之前
由于每种细胞对G418的敏感性不同,而且不同的厂家生产的相同浓度的G418的活性不尽相同,所以在筛选之前,一定要确定G418的最佳筛选浓度。具体如下:将细胞稀释到1000个细胞/mL,在100ug/mL~1mg/mL的G418浓度范围内进行筛选,选择出在10~14天内使细胞全部死亡的最低G418浓度来进行下一步的筛选试验。
由于每种细胞对G418的敏感性不同,一般变动在100ug/ml~1000ug/ml范围。而且不同的厂家生产的相同浓度的G418的活性不尽相同,所以在筛选之前,一定要确定细胞对这一批G418的最佳筛选浓度。尽管如此,特性明确的细胞系G418的最佳用量还是稳定的。《分子克隆》给出了几个常用细胞系所需G418的最佳用量。
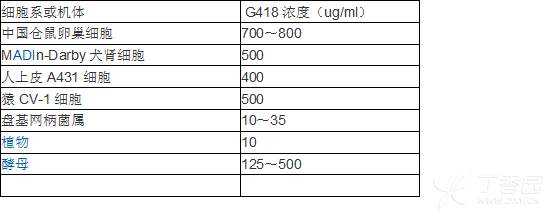
4、铺6孔板(20万/孔),第二天转染,6小时后换新鲜正常培养基。转染24小时后加最佳筛选浓度培养基,隔天换液。注意:细胞数量不能太多,否则将会影响筛选效果(G418很难发挥作用)。
5、在换液一两次后(换液后培养过夜),细胞达50%-80%时,吸出所有培养液,离心3000-4000rpm,吸上清0.22um过滤,加入2倍体积新鲜最佳筛选浓度培养液,混匀4℃备用。
6、培养6天左右细胞大量死亡时,可以换用适应性培养基,即6中所配制。或者可以增加血清浓度培养,例如原来用10%血清,此时则可以采用20%血清。
7、培养10天后将G418浓度减半,维持筛选压力。
8、培养10天后将G418浓度减半,维持筛选压力。
9、筛选约14天后可见有抗性克隆出现。
10、挑单克隆:高倍镜下标记阳性克隆,套环法或刮除法结合有限稀释法筛选阳性克隆,将其转入多孔板培养。
11、单克隆鉴定:细胞大量扩增后,①提取总RNA,RT-PCR检测目的基因的表达 ②western检测目的基因。
三、注意事项
培养液
加药筛选约6天左右,细胞会大量死亡,孔中只剩下的细胞寥寥无几。这时会出现两个问题:1。死亡的细胞会裂解释放出有害物质,导致那些有neo表达的阳性细胞死亡,即非选择性死亡。2。孔中细胞数目很少,细胞之间的信号会变得很弱,也会导致阳性细胞的状态不佳甚至死亡。这个时候需要一种特殊的培养液:假如你要转染3T3细胞,在3T3细胞汇合度达到80%的时候,换液,培养过夜之后收集培养液,通过滤器消毒,和新鲜的培养液按1:1混合备用。再转染后筛选过程中就可以应用这种培养基。
最后编辑于 2022-10-09 · 浏览 3206















































