EMBO J:中山大学崔隽教授等新发现抗病毒免疫中关键蛋白的降解机制
原创 2018-01-02 订阅号APExBIO
研究意义
天然免疫反应是人体抵抗病毒的第一道防线,RIG-I样受体(RLRs)在防止RNA病毒感染中至关重要。RIG-I样受体诱导I型干扰素(IFN)信号启动免疫反应,其降解会严重阻碍免疫应答,这种降解方式在已有的研究中被证实是泛素化介导的蛋白酶体降解。然而,近日,来自中山大学崔隽教授以及美国休斯顿卫理公会研究所王荣福教授的联合课题组揭示了一个新的机制,一个在RLR介导的I型IFN信号传导中具有关键作用的负调节因子——LRRC25,通过选择性自噬途径诱导RIG-1的降解来介导对I型IFN信号传导的抑制作用。在RNA病毒感染后,LRRC25特异性地结合已与ISG15结合的RIG-I并促进RIG-1与自噬载体受体p62之间的相互作用,以选择性自噬方式促进RIG-1降解。这项研究揭示了先天免疫信号与选择性自噬之间的相互作用,为抗病毒研究或癌症治疗以及寻找新的靶点提供了基础。该成果在线发表于《The EMBO Journal》。
当病毒入侵有机体时,病毒的病原相关分子模式(PAMPs)会触发有机体的先天免疫反应,成为抵御入侵病毒的第一道防线。在病毒感染的细胞中,可通过模式识别受体(PRRs)包括Toll样受体(Toll-like receptors,TLRs)、RIG-I样受体(RIG-I-like receptors,RLRs)以及几种DNA传感器来检测病毒RNA。RIG-I是RLR家族的主要成员,由保守的DEAD盒解旋酶/ ATP酶结构域、两个半胱天冬酶募集结构域(CARD)和C端调节结构域(CTD)组成。RIG-I的CTD结构域与病毒RNA结合后,CARD激活下游衔接子MAVS(也称为IPS-1,VISA或CARDIF)。然后MAVS触发信号级联启动I型干扰素(IFN)产生,以及多个IFN刺激基因(ISGs)和炎症细胞因子的下游表达,以启动免疫反应。
RIG-1在I型IFN活化中具有关键作用。目前的研究发现RIG-1的几种负调节因子(几种E3连接酶:包括RNF125,CHIP和Siglec-G / c-Cbl)通过控制RIG-I的降解来抑制I型IFN信号传导。然而除了这种泛素化介导的蛋白酶体降解途径,还没有发现其它降解系统来降解RIG-1,如溶酶体和自噬溶酶体降解系统。
在本项研究中,该团队发现了一个RLR介导的I型IFN信号传导的负调节因子,LRRC25(富含亮氨酸重复蛋白25)。在RNA病毒感染后,LRRC25特异性地与ISG15结合的RIG-I相互作用并结合p62以选择性自噬途径介导RIG-I的降解。LRRC25的异位表达抑制内源性IRF3(干扰素调节因子3)的磷酸化和RLR配体刺激后的I型IFN应答和抗病毒免疫,而LRRC25的沉默或敲除具有相反的作用。然而LRRC25对TLR3-或cGAS-介导的I型IFN活化没有影响,表明LRRC25特异性地抑制RLR诱导的I型IFN信号传导途径。LRRC25是RIG-I和p62相互联系的桥梁。有研究显示p62识别聚泛素化蛋白并通过UBA结构域将其募集至自噬体进行降解。然而,本文发现p62DUBA(缺乏泛素结合结构域)仍然与RIG-I相互作用,表明RIG-I和p62之间的相互作用独立于多泛素信号。此外,还发现缺乏所有已知泛素化位点的RIG-I-N(8KR)仍然可以通过自噬途径被LRRC25降解。说明LRRC25作为辅助受体以泛素信号独立的方式促进RIG-1的p62依赖性自噬降解。
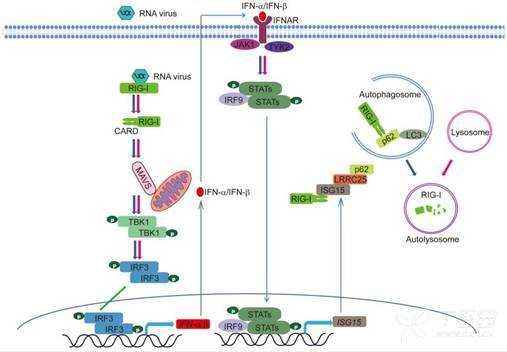
ISG15-LRRC25-p62轴负向调节I型干扰素信号的总机制图。
在RNA病毒感染后,LRRC25识别ISG15结合的免疫受体RIG-1并通过p62介导的选择性自噬促进其降解,从而限制RIG-I依赖性I型干扰素信号传导。RIG-I,ISG15和LRRC25之间的相互作用形成负反馈回路以阻止病毒感染后的免疫激活。
进一步探讨机制发现,ISG15对于RIG-I的p62依赖性降解是极其关键的。ISG15是泛素样蛋白,由I型IFN信号高度诱导并表现出抗病毒活性。ISG15主要通过两种方式发挥这种功能,一种是与其靶蛋白的赖氨酸缀合,一种是以游离的形式(未缀合的ISG15)。很多研究证实ISG15以偶联的方式负向调节RIG-I介导的抗病毒信号传导,但是游离的ISG15介导的机制尚不清楚,而且是否在自噬降解中发挥功能也一直未见报道。在这里显示,游离的ISG15与RIG-I相互作用,并作为一个必需的信号来抑制RIG-I介导的信号传导。免疫共沉淀结果显示病毒感染后,RIG-I首先与ISG15相互作用,然后再与LRRC25和p62相互作用。ISG15的缺失消除了RIG-I-p62相互作用以及RIG-I的自噬降解。这些结果说明LRRC25在RIG-I信号激活后通过游离的ISG15识别RIG-1,并通过p62介导的自噬途径将其靶向降解。
总之,这项研究结果揭示了ISG15和LRRC25在调节RIG-I介导的I型IFN信号传导中的功能。更重要的是,揭示了I型IFN信号传导可以与选择性自噬通路进行连接,证明先天免疫信号和选择性自噬是完全整合的。对于开发抗病毒和癌症治疗的新靶点具有重要的借鉴意义。(文章来源于APExBIO)
原始论文:
LRRC25 inhibits type I IFN signaling by targeting ISG15‐associated RIG‐I for autophagic degradation.
The EMBO Journal.
Published online 29.12.2017

















































