手把手教你使用Imagepro-Plus(11.免疫组化光密度测量)
 推荐
推荐http://www.dxy.cn/bbs/post/view?bid=10&id=3554359&sty=1&tpg=2&age=0
以前的帖子更多的是讨论IPP的操作方法,对实际应用说得较少,最近作了很多免疫组化的图象分析,总结一下分析方法。希望对其他使用的同学们有点用处。另有一个关于免疫组化图片分析方法的教学PPT,可以看看。(在下面附件里)
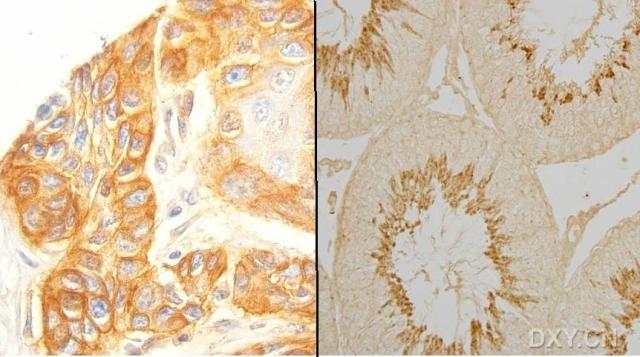
我这里说的免疫组化图片,是这样的一类图片:染上的颜色是黄色,如果染得浓,就呈现棕黄色。(制作样品的过程可别问我。我不知道)
要比较不同切片的光密度值来确定它们之间的蛋白表达的差异,首先要注意的就是这些切片样品要用尽可能完全一致的方法来处理。最近看到一个新技术挺不错,就是把各个样品定位后,各切出一个小细条,整整齐齐排成一个阵列,包埋在蜡块中,切成一片切片,然后进行免疫组化反应及染色处理。这样在一个载玻片上就有了数百个小切片,不仅它的的切片染色条件一致,还节省了抗体试剂。
切片当然首先得拍成照片才能进行分析。拍照也是一个重要环节,在显微镜下拍摄免疫组化照片需要注意以下几个要点:
1.所有照片必须在完全同样的显微镜条件下拍摄,在更换样品时,除了调整焦距和视野外,显微镜上的其他部件都不能动!所有的样品必须一次拍摄完全。特别是在拍摄过程中,不要一会用高倍镜,一会用低倍镜,来回切换物镜。当然,在使用高倍镜时对焦及寻找视野会稍麻烦一点,但也没办法。保持各张切片的拍摄条件一致更重要。
2.数码相机必须设置为手动曝光,并且保持每张照片用同样的曝光条件,同样的曝光时间,同样的光圈。特别要注意的是,一定要将数码相机的自动白平衡功能给关掉!!!
3.免疫组化切片一般染色不太深,因此拍摄出的照片颜色较浅,就让它浅。拍摄出的照片中空白部位应尽可能呈现纯白色。测量其灰度应在230-240之间。如果呈现淡蓝色,一般是相机自动白平衡在起作用。另外一个因素是显微镜灯光电压不正确。要使灯光本身的色温正确。既不偏黄,也不偏蓝。下面两张照片中左边一张是合适的曝光,右边那张不好。