超详细解析---免疫沉淀质谱(IP-MS)实验基本原理及实践操作--保姆教程
 花匠是自己 推荐
花匠是自己 推荐
1 背景知识介绍
在基因调控网络(Gene regulatory network, GRN)中起作用的转录因子通常与其他蛋白质相互作用,例如染色质重塑因子、组蛋白修饰因子和其他辅助调节因子。表征这些相互作用对于理解转录因子的功能和作用机制至关重要 [1]。
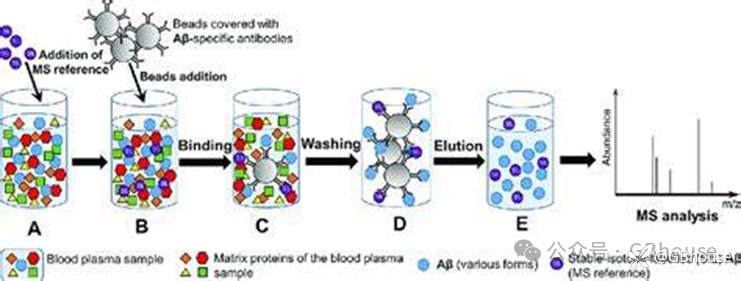
(图1 IP-MS基本原理示意图)
免疫沉淀质谱(Immunoprecipitation-Mass Spectrometry, IP-MS),可高效筛选并鉴定与靶蛋白直接或间接结合或相互作用的未知蛋白,并对其进行定性及定量分析。蛋白质相互作用(Protein-Protein interactio,PPI和翻译后修饰Post-translational modification, PTMs)的数据是能显著提高基础类研究文章档次的重要内容,因此IP-MS也是文章加分的重要实验。
通过一次IP-MS实验,能高通量的鉴定和筛选到多个与要研究的目的蛋白(target) 存在相互作用的蛋白质(蛋白质复合物组分),从而拥有属于自己的专属蛋白质相互作用数据库,能够进行更深入的进行生物学功能和分子机制的研究。IP-MS实验要求对抗体要求较高,建议尽量使用经过高分文章验证过的IP抗体和磁珠。
IP-MS关键实验步骤:
(1)天然活性总蛋白提取,提取过程中需要加入蛋白酶抑制剂、磷酸化蛋白酶抑制剂或直接使用试剂盒中的蛋白相关抑制剂;
(2)抗原抗体结合,提取完成的活性(不能高温变形)蛋白立即进行抗原抗体孵育(因为结合较弱的蛋白可能因为冷冻保存导致结合丢失);
(备注:有的试剂盒要求抗体先和磁珠结合,其实影响不大,不过可以根据protein A/G试剂盒建议的操作执行)
(3)抗原-抗体-磁珠结合,将(2)作为工作液加入protein A/G于4℃ 360°旋转摇床孵育过夜(12-16h);
(4)抗原-抗体-磁珠富集,将(3)工作液置于磁力架上作用10sec,即可将上清液和磁珠进行分离,并将上清液专业至新的离心管(用于对照);
(5)蛋白变性,将(4获得的蛋白)直接使用loading buffer进行处理,然后于95-100℃进行变性(3-5min);
(6)SDS-PAGE分离,使用8%分离胶(因为IP拉下来的蛋白位置大小),上样在100μg左右(因为IP或者的某些蛋白表达量低),完成上样后跑胶;
(7)考染或银染PAGE胶,将PAGE胶使用考染(MS效率更佳)或银染(灵敏度更高),一般选择考染,然后送测序公司进行质谱(MS)分析。
(8)质谱测序;
(9)数据分析,找到关键hub蛋白。
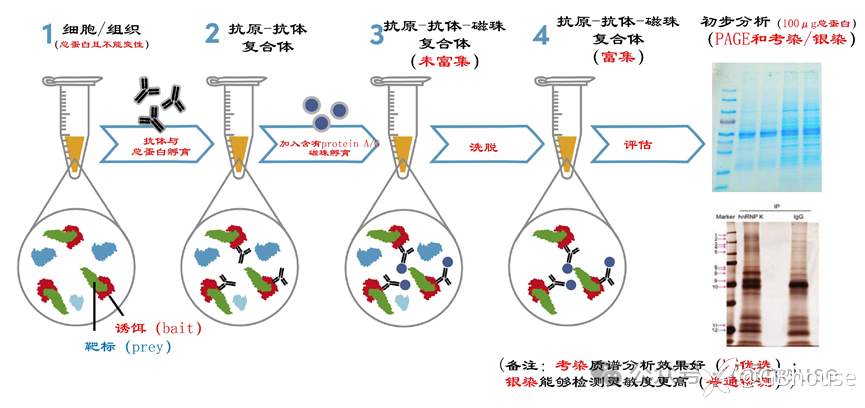
(图2 免疫沉淀质谱分析-实验室基本操作流程示意图)
2 IP实践操作
2.1 样品准备
免疫沉淀(Immunoprecipitation ,IP )是利用抗原-抗体特性性结合的一种亲和结合技术,广泛应用于从组织或细胞裂解物中天然靶蛋白的富集于分离。注意:为了保持总蛋白的活性,实验样品尽量冰上或4℃进行。
选择与研究材料相匹配的生物材料(组织/细胞/其它)在冰面上裂解并提取天然活性蛋白。
Tips 1:高浓度的去垢剂会干扰IP效果,因此在裂解过程个可以先试用小体积裂解液(RIPA)进行样品裂解,然后补充1x PBS或孵育液至需要体积;
Tips 2:足够量的组织/细胞样品,一般IP 需要1–3 mg总蛋白(细胞>1×107;组织>100mg;细菌湿重>1mg;植物>100mg;血清>50ul),初始体积建议裂解液0.2–0.4 ml,然后使用1x PBS或孵育液补充至1ml(注意:没有经验的情况,补充至0.5 ml,经过BCA测定总蛋白浓度后进行蛋白浓度调整);
Tips 3:高浓度蛋白酶抑制剂,为保证天然活性蛋白不被酶处理,建议使用平时western blot蛋白酶抑制使用量的2倍数。
2.2 IP时间操作步骤(以细胞为例)
(1)活性蛋白提取:使用3/4添加2x 蛋白酶抑制剂的RIPA工作液裂解细胞(可以适当加上超声辅助),冰上放置30 min,每5 min吹打细胞,最后使用1×PBS补充至最终体积;
(备注:IP裂解液参考用量:<10cm dish细胞使用500 μL RIPA;10 cm dish细胞(1.3 × 107cells),用1 mL RIPA;15 cm dish细胞(2× 107cells),用2 mL RIPA。)
(2)离心收集蛋白:在4 °C执行20,000g离心15 min收集上清并转移至灭菌1.5 ml EP管中;
(3)抗体孵育:获得的总蛋白立即使用相应抗体进行,加入适量的抗体,4℃360°摇床旋转孵育2-4h(注意做好分组:实验组,对照组(即IgG组));
(备注1抗体使用量:少于<10 cm dish细胞使用1-3μg高质量抗体;10 cm dish细胞,加入3-5 ug高质量抗体;15 cm dish细胞,加入5-10 μg高质量抗体。(高质量:买来后没有反复冻融,就赶紧做);备注2:也可以先将抗体使用抗体稀释液稀释后与磁珠4℃360°摇床旋转孵育1-2h,然后再与总蛋白孵育)
(4)磁珠洗涤:一般protein A/G保存在保存液里,使用前需要使用TBS(或磁珠试剂盒自带洗涤液进行洗涤),在磁力架上将磁珠和洗涤液分离,丢弃洗涤液(洗涤2-3次);
(备注磁珠使用量:<10 cm dish细胞量,5 μL protein A/G磁珠;10 cm dish细胞量,protein A/G 10μL磁珠;15 cm dish细胞量, 15 μL protein A/G磁珠,或根据说明书,不过适当多加点有好处)
(5)磁珠平衡,使用提取蛋白的裂解液(RIPA)4℃平衡磁珠10min,在磁力架上将磁珠和洗涤液分离,丢弃裂解液;
(6)Protein A/G与抗原-抗体结合:步骤(3)液体转移至洗涤后的protein A/G磁珠EP管中,使用封口膜封口EP管,于珠4℃360°摇床旋转孵育过夜(12-16h);
(7)磁珠分离:将装有(6)工作液的EP管置于磁力架上静置10-20sec进行分离磁珠和液体,转移上清至新的EP管中(用作考染/银染阳性对照);
(8)洗涤非阳性结合:使用1 mL Wash Buffer颠倒混匀后或在摇床上作用5min,在磁力架上静置10-20sec分离磁珠(重复清洗三次);
(9)IP蛋白分组:最后一次洗涤时,将1/4体积protein A/G磁珠用于western blot 和PAGE考染/银染验证;
(备注:也可以直接将考染或银染的胶切割后送测序)
(10)磁珠保存:剩余3/4 protein A/G磁珠混合溶液,于磁力架上作用10-20sec吸弃上清,仅保留干protein A/G磁珠保存-20 °C或送测质谱;
(11) IP蛋白预处理:1/4 protein A/G磁珠于磁力架作用10-20sec后吸弃上清液,加入Loading Buffer(终浓度为1×)95-100℃变性3-5min,于磁力架上作用10-20sec,转移上清至新的EP管(含有IP下来的蛋白);
(12)IP蛋白western blot和SDS-PAGE验证:制备两块SDS-PAGE胶,分别进行WB实验和考染银染染色;
(13)结果解读:western blot显示有目的蛋白条带;考染/银染结果存在多个蛋白条带,实验组和对照组均有大量条带,表明IP实验过程正常。(备注:对于一些蛋白较大的,例如>100 kDa可能考染染不出来,需要WB佐证)。
3 注意事项
(1)高质量抗体:使用高质量抗体,抗体的高亲和力特性和高特异性的抗体以确保有效的IP实验结果,抗体买回后,避免反复冻融,可以分装或
(2)天然活性蛋白:操作过程中在冰面上处理,并加入足量蛋白酶抑制剂避免样品降解和非特异性结合;
(3)洗涤条件:实验过程中优化洗涤条件和步骤可以减少非特异性背景和非特异性结合;
(4)足够的天然后续蛋白:因为IP过程,存在不少的结合较弱或者表达较低的蛋白,建议使用足够量的蛋白,保证IP能够检测到特定的结果。
(5)细胞使用量:建议使用至少2×107数量的细胞(获得约5 mg蛋白)或更高进行IP实验,增加IP实验过程中的蛋白起始量可以提高IP-MS检测深度;
(爱自己!!!做科研!!! 每文格《菜根谭》“路经窄处,留一步与人行;滋味浓处,减三分让人尝。”如果有用,关注楼主GBhouse,点赞+讨论,攻击性人格请请请不要关注和阅读!!!)
参考:
[1] Smaczniak C. Immunoprecipitation-Mass Spectrometry (IP-MS) of Protein-Protein Interactions of Nuclear-Localized Plant Proteins. Methods Mol Biol. 2023;2698:163-181. doi: 10.1007/978-1-0716-3354-0_11. PMID: 37682475.
[2] IP注意事项https://zhuanlan.zhihu.com/p/662174391
[3] IP原理及实验过程 https://zhuanlan.zhihu.com/p/696077746
[5] IP-MS ; Co-IP-MS, 互作蛋白检测及鉴定http://www.ease-bio.com/productview.asp?/1.html
[6] 免疫沉淀 (IP) 技术指南和实验方案https://assets.thermofisher.cn/TFS-Assets/BID/Technical-Notes/TR0064-Immunoprecipitation-guide-zh.pdf
















































