脂蛋白a在心血管疾病中的研究新进展
由于我国人口结构趋向高龄化以及居民生活习惯不断改变,动脉粥样硬化性心血管疾病(ASCVD)的发病率和死亡人数持续上升,严重威胁国民生命健康[1]。血脂异常是ASCVD的重要危险因素,近年来,我国国民血脂异常患病率不断增加,血脂管理亟待改善[2]。即使是在他汀类等降脂药物广泛使用的情况下,以ASCVD为代表的心血管疾病风险仍居高不下,这部分残余心血管疾病风险主要来源于残余胆固醇和脂蛋白a[Lp(a)][3]。Lp(a)包括1分子低密度脂蛋白(LDL)样颗粒和1分子大小各异的载脂蛋白a[Apo(a)],并连接有氧化磷脂(OxPL),其结构组分提示,Lp(a)可能在促进动脉粥样硬化、促进血栓形成以及促进炎症反应中发挥重要作用[4]。血浆Lp(a)水平主要由遗传因素决定,LPA基因编码Apo(a),通过影响Apo(a)异构体的大小,进而影响血浆Lp(a)水平[5]。大量研究表明,Lp(a)是ASCVD的独立危险因子[6-7],且与冠心病的发病、严重程度以及不良预后均显著相关[8]。Lp(a)测量对于评估心血管疾病风险至关重要,然而Lp(a)水平检测受到Apo(a)大小异质性的影响,并且临床上Lp(a)水平的检测率不高[9]。此外,目前尚无有效的特异性降低Lp(a)水平的药物应用于临床[10]。基于上述理论,Lp(a)引起了学者的广泛关注,本文就Lp(a)的结构、功能、遗传学特性、检测现状、与心血管疾病的关系以及降Lp(a)治疗新进展进行系统的总结与阐述。
1 本文文献检索策略
本文以“脂蛋白a”“血脂”“心血管疾病”为关键词,检索万方数据知识服务平台,以“Lipoprotein(a)”或“Lp(a)”为关键词检索PubMed数据库,检索时间设定为2019年1月—2024年2月。纳入标准:符合本文阐述主题的高质量文献,以及所选文献中涉及的其他重要文献;排除标准:与本文主题不相关以及文章内容不严谨的文献。最终纳入104篇文献进行综述。
2 Lp(a)概述
2.1 Lp(a)结构
Lp(a)是一种特殊的血浆脂质,由挪威医生BERG[11]于1963年首次描述。Lp(a)由Apo(a)和包含载脂蛋白B-100(ApoB-100)的LDL类似颗粒按1∶1的比例组合而成,两者之间通过二硫键连接,详见图1。Apo(a)由肝细胞合成并分泌,是一种高度多态性的亲水性糖蛋白,大小与Lp(a)水平显著相关[4]。Apo(a)包含被称为Kringle的环状蛋白质结构,与纤溶酶原(PLG)氨基酸序列具有较高的同源性,但Apo(a)只有Kringle 4型和Kringle 5型两种结构域,而PLG有5种结构域(KⅠ~KⅤ)。K Ⅳ具有10种类型,其中KⅣ-2存在由遗传决定的重复数目变异,导致Apo(a)大小的多样性。Apo(a)还连接有一段无功能的蛋白酶结构域,因而无蛋白水解活性[10]。此外,Lp(a)与OxPL结合,赋予其促炎活性[12]。
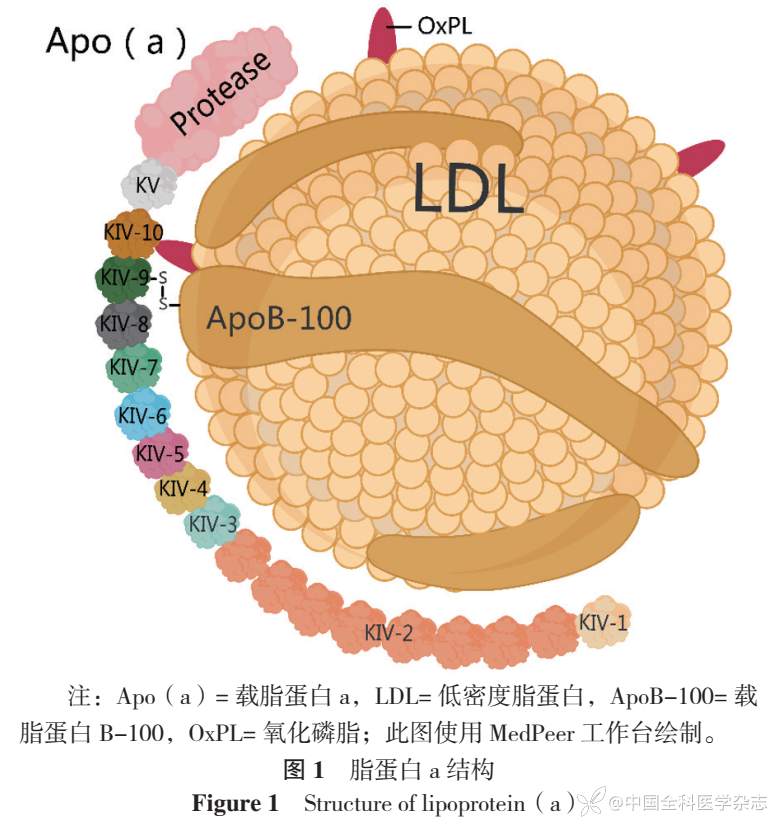
2.2 Lp(a)功能
目前,Lp(a)的病理生理机制仍不十分清楚。Lp(a)颗粒的结构组分表明,Lp(a)可能连接脂质代谢和纤溶系统。Lp(a)可沉积在动脉壁,激活血管单核巨噬细胞和内皮细胞,促进炎性细胞因子释放和黏附因子表达,募集炎症细胞;也可促进血管平滑肌细胞增生,增加泡沫细胞形成;并能与成纤维细胞和细胞外基质成分相互作用,共同促进动脉粥样硬化的发生、发展[5,13-15]。Lp(a)还可与多种血小板受体相互作用发挥效应。Lp(a)水平较高的患者,更容易从抗血小板治疗中获益[16-17]。此外,一项基于载脂蛋白B(ApoB)的遗传学分析显示,Lp(a)的动脉粥样硬化性明显大于LDL[18]。另有研究表明,Lp(a)是OxPL的优先载体,Lp(a)的OxPL的促炎作用具有致动脉粥样硬化潜能[12]。OxPL与Lp(a)在动脉和主动脉瓣病变中共定位,并可通过促进内皮功能障碍、脂质沉积、炎症和成骨分化,参与动脉粥样硬化性血栓形成和主动脉瓣钙化[15]。机制研究表明,Lp(a)水平升高能够使纤维蛋白凝块渗透性降低、结构改变、溶解时间延长,从而抑制纤溶反应[19-21]。然而,大型遗传学研究表明,Lp(a)与静脉血栓栓塞或血栓形成风险无关[22-23]。
2.3 Lp(a)遗传特性
Lp(a)水平在不同种族、不同地区以及不同个体之间存在巨大差异[24-26]。与其他脂蛋白不同,血浆Lp(a)水平受生活方式改变或降脂药物的影响最小,主要由编码Apo(a)的LPA基因决定。LPA基因坐落在人类第6号染色体上,能解释>90% Lp(a)水平的变化[5]。LPA基因KⅣ-2段拷贝数目的可变性,是导致血浆中Lp(a)水平变异的重要原因,KⅣ-2拷贝数越多,Apo(a)蛋白异构体越大,合成效率越低,因而血浆Lp(a)水平越低[27]。LPA基因KⅣ-2拷贝数与Lp(a)水平的负性相关关系已被多项研究证实[28-30]。除KⅣ-2拷贝数目外,多种功能性单核苷酸多态性(SNPs)变异与Lp(a)水平和心血管风险相关,SNPs和KⅣ-2拷贝数之间以及不同SNPs之间存在复杂的相互作用[27]。一项横断面研究结果表明,对高Lp(a)水平个体的一级亲属进行级联筛选,可识别其他ASCVD风险个体,这进一步支持Lp(a)水平受遗传因素控制[31]。
2.4 Lp(a)检测
血浆Lp(a)水平主要通过Apo(a)特异性免疫检测法进行检测。然而,由于Apo(a)的大小特异性,可能导致Lp(a)水平被低估或高估。为了实现Lp(a)测量的准确性和标准化,使用标准的国际参考试剂和5个独立的Lp(a)范围较大的标准品,可以减少Apo(a)大小对水平测定的影响[32]。Lp(a)检测有两种报告单位,mg/dL和nmol/L,鉴于单个Lp(a)组分的质量差异,以nmol/L为单位的检测方法被推荐[9]。此外,一种可绝对定量Apo(a)的靶向液相色谱串联质谱(LC-MS/MS)检测方法,可作为Lp(a)标准化测定的候选参考方法[33]。
目前,临床上很多医院并未常规检测血浆Lp(a)水平。有指南建议,应在特定人群中测量Lp(a)水平[34]。而欧洲动脉粥样硬化学会共识声明建议,成年人应至少测量1次Lp(a)水平[35]。芬兰一项青年心血管风险研究表明,青少年时期Lp(a)水平升高是中年发生ASCVD的危险因素,表明在年轻人中测量Lp(a)有助于识别未来ASCVD风险较高的个体并提前干预[36]。综合多项研究和指南,早期测量Lp(a)水平,可有助于心血管疾病的预防、风险分层和治疗药物选择。
3 Lp(a)与心血管疾病的关联
3.1 Lp(a)与冠心病
多项大型遗传学研究以及观察性队列研究结果表明,血液中Lp(a)水平与包括冠心病在内的ASCVD风险显著相关[6-7,37-38]。且涉及多个种族的大型队列研究显示,无论基线是否存在ASCVD,Lp(a)均与ASCVD事件风险增加相关[39]。另有多项研究表明,Lp(a)与冠状动脉粥样硬化体积、冠状动脉SYNTAX-Ⅰ评分和Gensini评分以及多支血管病变冠心病均有关,表明Lp(a)水平升高与冠状动脉严重程度密切相关[8,40-41]。一项涉及7个种族的研究表明,较高的Lp(a)水平也与心肌梗死风险增加相关[25]。此外,Lp(a)水平对冠心病的预后有重要影响。在稳定型冠心病患者中,高Lp(a)水平可加速冠状动脉斑块的进展,从而影响患者的预后[42-43]。在心肌梗死患者中,高Lp(a)水平也可提高主要不良心血管事件(MACE)发生率[44]。同时,多项流行病学研究表明,无论基线时是否存在ASCVD,Lp(a)水平升高均与MACE和冠状动脉血运重建风险增加有关[45-47]。关于患者糖代谢状态对Lp(a)与冠心病预后之间相关性的影响,一项前瞻性研究表明,只有在同时患有糖尿病的心肌梗死患者中,Lp(a)才与MACE风险相关[44]。而一项多中心研究表明,Lp(a)水平升高也会影响伴有轻度糖代谢受损的稳定型冠状动脉疾病患者的预后[43]。两项研究之间研究人群选择不同以及糖代谢状态分类不同,可能是造成两项研究结论稍有差异的主要原因,有待后续研究进一步验证。
虽然有回顾性队列研究未观察到Lp(a)与死亡率增加的相关性[37],但是来自中国的一项前瞻性队列研究发现,Lp(a)与全因死亡风险和心血管疾病相关死亡风险相关[48]。一项荟萃分析进一步证明,在普通人群和心血管疾病患者中,较高的Lp(a)水平均与较高的全因死亡率和心血管死亡风险相关[49]。此外,有研究表明,高水平和低水平的Lp(a)均与心肌梗死后总死亡率和心血管事件复发的风险增加有关[50]。
综上所述,Lp(a)与ASCVD、冠心病和心肌梗死的发病、冠状动脉狭窄严重程度、不良心血管预后以及全因死亡和心血管死亡风险均显著相关。
另外,也有研究关注Lp(a)与超敏C反应蛋白(hs-CRP)的交互作用。先前研究表明,Lp(a)相关的ASCVD风险仅在伴随hs-CRP升高时被观察到[51]。并且,在hs-CRP水平升高的冠心病患者中,高Lp(a)水平与较差预后的相关性更强[52]。而欧洲一项基线无相应疾病的前瞻性队列研究结果表明,无论C反应蛋白(CRP)水平如何,高水平Lp(a)均是ASCVD和心肌梗死的主要危险因素[53]。最新研究表明,在无冠心病个体中,无论hs-CRP水平如何,Lp(a)均与冠心病事件显著相关,而在基线时患有冠心病的个体中,Lp(a)仅在hs-CRP水平较高时与冠心病事件复发相关[54]。由此可见,hs-CRP是否影响Lp(a)与冠心病发病及预后之间的相关性,取决于基线时个体是否患有冠心病。
3.2 Lp(a)与缺血性卒中
来自中国的一项前瞻性社区队列研究表示,Lp(a)水平升高加速颈动脉斑块进展,并且导致斑块易损,提示Lp(a)可能与缺血性卒中相关[55]。虽然有回顾性队列研究未发现Lp(a)水平与缺血性卒中的关联[37],但也有多项前瞻性队列研究证实Lp(a)是缺血性卒中的危险因素[56-58]。此外,多中心队列研究显示,在有明显动脉硬化疾病的高加索人群中,Lp(a)升高与脑血管事件复发风险独立相关[59]。综上所述,多项研究证实Lp(a)水平升高与缺血性卒中风险及预后显著相关。
3.3 Lp(a)与外周动脉疾病(PAD)
有回顾性队列研究未观察到Lp(a)与PAD之间的关联[37]。而在哥本哈根普通人群研究中,高Lp(a)水平增加PAD和主要不良肢体事件(MALE)的风险[60]。另一队列研究也表明,无论基线hs-CRP水平如何,较高水平的Lp(a)与PAD相关[47]。此外,在接受血运重建术治疗的PAD患者中,Lp(a)水平升高与MACE和MALE独立相关,独立于低密度脂蛋白胆固醇(LDL-C)水平和他汀类药物的使用[61]。由此可见,Lp(a)水平升高显著增加PAD的发病风险以及PAD患者的不良事件风险。
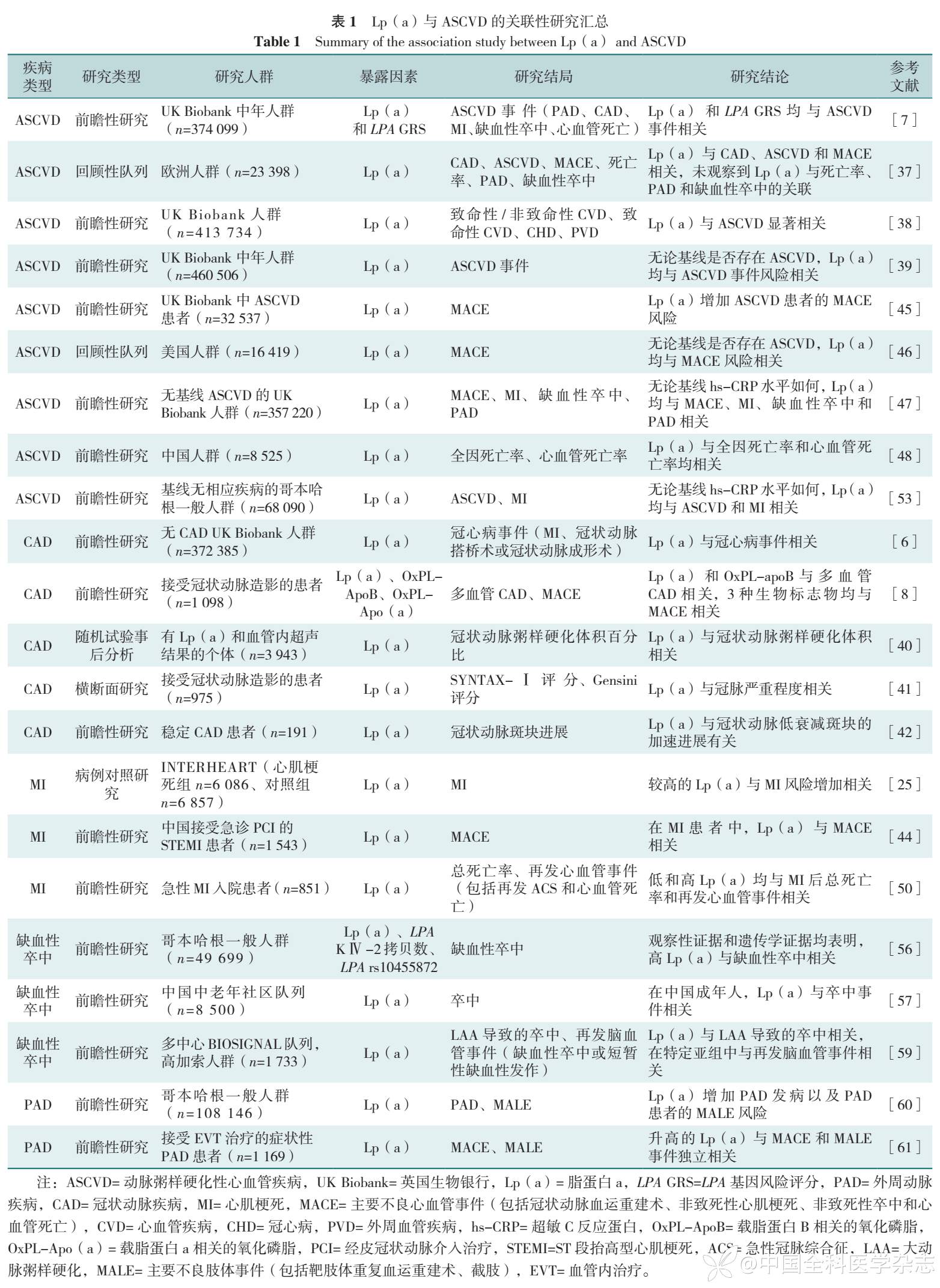
综上所示,Lp(a)与ASCVD(包括冠心病、心肌梗死、缺血性卒中、PAD等)发病及预后显著相关,详见表1。
3.4 Lp(a)与主动脉瓣狭窄
多项研究证实,Lp(a)与主动脉瓣狭窄显著相关[38,53]。关于主动脉瓣狭窄患者的钙化风险,有研究发现,Lp(a)对轻至中度主动脉瓣狭窄患者的钙化活动无重大影响[62],也有研究表明,在主动脉瓣狭窄患者中,Lp(a)和OxPL驱动瓣膜钙化和疾病进展[63]。先前有研究表明,Lp(a)与主动脉瓣钙化的发生有关,但与进展无关[64]。而一项荟萃分析结果表明,Lp(a)水平与主动脉瓣钙化和狭窄发病、进展以及不良预后相关[65]。综上所述,Lp(a)与主动脉瓣狭窄显著相关,详见表2;而Lp(a)是否影响主动脉瓣狭窄患者的钙化风险以及主动脉瓣钙化的进展,目前尚有争议,需要进一步研究予以明确。

3.5 Lp(a)与其他心血管疾病
关于Lp(a)与心房颤动的关联,目前研究中存在相反的结论。有研究表明,较高水平的Lp(a)与较低的心房颤动发病率相关[66-67]。而一项大型孟德尔随机化研究表明,Lp(a)在心房颤动的发展中是一个潜在的因果递质,并且这种效应部分独立于其通过对ASCVD的已知影响而影响心房颤动,这表示Lp(a)的作用延伸到整个心肌组织[68]。同时,Lp(a)水平升高可增加心肌纤维化、心肌瘢痕和左房重构发生率,同样暗示Lp(a)可能影响心肌组织[69]。Lp(a)与心房颤动的关联以及Lp(a)对心肌组织的影响,值得深入探索。
目前没有发现低Lp(a)水平是有害的[70]。但有研究表明,极低Lp(a)水平增加2型糖尿病的发病风险,而将Lp(a)水平最高的20%个体的Lp(a)水平降至人群中位数,不增加2型糖尿病的发病风险[29]。
4 降Lp(a)治疗进展
孟德尔随机化分析显示,降低Lp(a)水平可以降低冠心病风险[71]。一项基于人群的研究显示,在二级预防中,短期内将Lp(a)水平降低50 mg/dL,可使心血管疾病风险降低20%[72]。常规用于降脂治疗的他汀类药物明显升高血浆Lp(a)水平[73]。一项荟萃分析显示,在冠心病高危患者中,与安慰剂相比,他汀类药物对Lp(a)相关的心血管事件风险没有影响[74]。因而,在Lp(a)较高的患者中,可使用他汀类药物进一步降低LDL-C相关的心血管风险[75]。然而,目前还没有直接针对Lp(a)的药物治疗可用于临床,下面将详细介绍可降低Lp(a)水平的药物和治疗方法,以及其治疗地位。
4.1 一般不用于临床的可降低Lp(a)的药物
一项临床随机对照试验的荟萃分析显示,缓释烟酸治疗可使受试者Lp(a)水平平均降低23%[76]。此外,雌激素替代治疗和雌激素受体调节剂他莫昔芬也可降低Lp(a)水平[77-78]。然而,由于以上疗法有一定的不良反应,且对心血管风险的影响不明确,一般不用于临床降低Lp(a)水平[75]。
4.2 临床上可轻中度降低Lp(a)的药物
4.2.1 前蛋白转化酶枯草杆菌蛋白酶Kexin-9(PCSK9)抑制剂:已被用于降脂治疗的PCSK9抑制剂可降低LDL-C和Lp(a)水平[79-80]。
在他汀类药物治疗的患者中,PCSK9抑制剂Alirocumab通过加速Lp(a)颗粒分解代谢来降低血浆Lp(a)水平[81]。而在他汀类药物治疗的Apo(a)水平非常高的患者中,Alirocumab通过增加清除率和降低产率双重作用来降低血浆Lp(a)水平[80]。此外,Apo(a)水平与PCSK9抑制剂诱导的Lp(a)的相对降低呈正相关[82]。一项3期临床研究结果显示,Alirocumab可通过降低Lp(a)水平,从而降低急性冠脉综合征(ACS)后MACE风险,并且不依赖于降低LDL-C[79,83]。在基线时Lp(a)升高的患者中,从Alirocumab治疗降低风险中获益更大[84]。并且,基线高水平Lp(a)患者相较于安慰剂组,Alirocumab增加2型糖尿病发病风险[85]。Alirocumab还可降低PAD事件风险,尤其是在高Lp(a)患者中[86]。
一项随机临床试验表明,另一种PCSK9抑制剂Evolocumab可显著降低Lp(a)水平,并降低心血管事件风险,并且基线Lp(a)水平较高的患者从中获益更大[87]。此外,抑制PCSK9可通过降低Lp(a)水平显著降低静脉血栓栓塞(VTE)的发生风险[88]。
4.2.2 依折麦布:荟萃分析结果表明,与安慰剂相比,依折麦布可降低原发性高胆固醇血症患者的Lp(a)水平,但降低幅度较小,需要进一步探索依折麦布与其他药物联用的效果[89]。
4.2.3 胆固醇酯转运蛋白(CETP)抑制剂:CETP抑制剂能够升高高密度脂蛋白胆固醇(HDL-C)水平、降低LDL-C水平,进一步降低ASCVD患者的不良事件风险[90]。临床试验证实,在轻度高胆固醇血症患者中,CETP抑制剂Anacetrapib也可通过减少Lp(a)生成来降低Lp(a)水平[91]。此外,CETP抑制剂Evacetrapib单独或联用他汀类药物均可降低Lp(a)水平,对心血管风险的影响需要进一步研究证实[92]。
4.3 新兴药物
目前有几种小核酸药物和小分子药物正在临床试验过程中,有望成为降低Lp(a)的新兴药物。
4.3.1 小干扰核糖核酸(siRNA):Olpasiran是一种合成的双链的N-乙酰半乳糖胺偶联的siRNA,可直接抑制肝细胞中LPA信使核糖核酸(mRNA)的翻译。1期剂量递增临床试验验证了Olpasiran的安全性和耐受性,并证实了肝细胞靶向siRNA可以在Lp(a)水平升高的个体中有效降低Lp(a)水平[93]。随机、双盲、安慰剂对照试验证明,Olpasiran治疗可显著降低ASCVD患者的Lp(a)水平,目前Olpasiran正在进行3期临床试验[94]。
SLN360是一种靶向肝脏Apo(a)合成的siRNA,可诱导食蟹猴血清Lp(a)水平持续降低[95]。在1期临床试验中,SLN360耐受性良好,并且在Lp(a)水平升高且无已知心血管疾病的参与者中,可剂量依赖性降低Lp(a)水平[96]。Lepodisiran也是一种siRNA,抑制Apo(a)的肝脏合成,随机单次递增剂量试验表明,Lepodisiran耐受性良好,并可剂量依赖性降低血清Lp(a)水平[97]。
4.3.2 反义寡核苷酸(ASO):Pelacarsen是一种N-乙酰半乳糖胺偶联的ASO药物,可抑制Apo(a)的mRNA合成[10]。1期和2期随机、双盲、安慰剂对照、剂量范围临床试验表明,Pelacarsen未偶联的前体能以剂量依赖的方式降低Lp(a)水平,并且无明显不良反应[98-100]。Pelacarsen可显著降低直接Lp(a)胆固醇[Lp(a)-C],并具有轻至中度降低经校正的LDL-C的作用[101]。目前,一项3期临床试验正在测试Pelacarsen对心血管疾病患者MACE的影响[10]。
一项荟萃分析显示,尽管Mipomersen对血脂有良好的影响,但由于停药风险增加、注射部位反应、肝脂肪变性、肝酶升高和流感样症状风险增加等不良反应,研究被中断[102]。
4.3.3 小分子药物:Muvalaplin是一种口服小分子药物,通过阻断Apo(a)和ApoB-100相互作用来抑制Lp(a)的形成,同时避免与同源蛋白纤溶酶原相互作用。1期随机双盲临床试验证明,Muvalaplin耐受性良好,并可明显降低Lp(a)水平[103]。
4.4 脂蛋白单采术
脂蛋白单采术可安全有效地降低血浆Lp(a)水平,并可显著降低ASCVD风险。然而,由于脂蛋白单采术操作难度大、对设备和人员要求高且为有创操作,需要医患双方共同评估风险收益并决策[104]。
5 总结与展望
多项流行病学研究和遗传学研究证据证实,Lp(a)与ASCVD发病和MACE风险增加显著相关。然而,临床上广泛用于降脂的他汀类药物,不仅不会降低Lp(a)水平,反而会升高血浆Lp(a)水平。作为新兴降脂药物,PCSK9抑制剂也可降低Lp(a)水平,从而进一步降低心血管事件风险。同时,有几种siRNA和ASO药物正处在临床试验阶段,试验证明可降低Lp(a)水平和心血管事件风险。但是目前的药物临床试验主要针对已患有心血管疾病的患者,未涉及一般人群,因而有必要在未患有心血管疾病的普通人群中,通过随机对照试验,进一步验证药物降低Lp(a)水平是否有助于ASCVD的一级预防。此外,目前关于Lp(a)的系列研究主要在欧美人群中进行,鉴于Lp(a)水平的种族特异性,在其他人群中进行Lp(a)相关研究很有必要。在我国汉族人群中系统进行Lp(a)的遗传学研究和疾病关联研究,将有助于指导国人的血脂管理。
参考文献略
















































