“应知应会”双荧光素酶报告系统原理与实验操作
 花匠是自己 推荐
花匠是自己 推荐
1 背景知识介绍
1.1 双荧光素酶报告系统
双荧光素酶报告系统(dual luciferase reporter):萤火虫荧光素酶(Firefly luciferases)和海肾荧光素酶(Renilla luciferases),由于其不同的进化起源,具有不同的酶结构和底物需求。
1.2 萤火虫荧光
1.2.1 萤火虫荧光反应
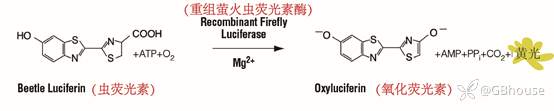
萤火虫荧光素酶是一种61kDa的单体蛋白,不需要翻译后加工就能产生酶活性, 因此,它在翻译后立即发挥遗传报告基因的作用。萤火虫荧光素酶光发射(Photon emission)需要重组萤火虫荧光素酶、氧气、ATP和Mg2+同时存在才能发光,发光颜色为黄色[1-2],反应如图1所示。
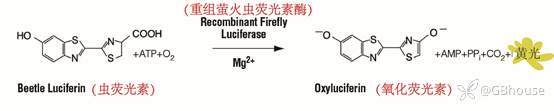
(图1 萤火虫荧光素酶参与反应)
1.2.2 萤火虫荧光应用
萤火虫荧光素酶:一般是作为告基因(启动子 5’UTR/非编码RNA,例如miRNA (3’UTR),lncRNA (intergenic),ceRNA等) 的载体,将目的基因构建在该载体上,从而反应目的序列调控活性的作用结果,因此根据实验目的,可以针对此质粒进行改造,构建重组质粒用于验证序列,载体的工作原理如下图所示(以启动子和miRNA举例) [3]:

(图2 报告基因系统工作及检测原理示意图)
1.3 海肾荧光素酶
1.3.1 海肾荧光素酶反应
海肾荧光素酶(Renilla luciferase)是一种36kDa的单体蛋白,从其天然来源海肾(Renilla reniformis)中纯化后,含有3%的碳水化合物组成[4]。然而,与萤火虫荧光素酶一样,其活性不需要翻译后修饰,该酶可能在翻译后立即发挥遗传报告基因的作用。海肾荧光素酶催化的发光反应利用O2和腔肠荧光素酶。
(图3 海肾荧光素酶参与反应)
1.3.2 海肾荧光素酶应用
海肾荧光素酶(Renilla luciferase)通常作为报告基因的内参,用于报告基因的归一化处理。在实验实践操作过程中,通常会遇到各种误差误差,例如细胞数目不均一、构建的质粒质量差异、细胞状态不统一、转染效率不一致等因素。引入海肾荧光素酶收集的荧光数据作为去归一化报告基因,以此来相对定性检测报告基因的测量结果,从而达到有效地减少实验误差的目的,海肾荧光素酶载体的工作原理如下图所示:
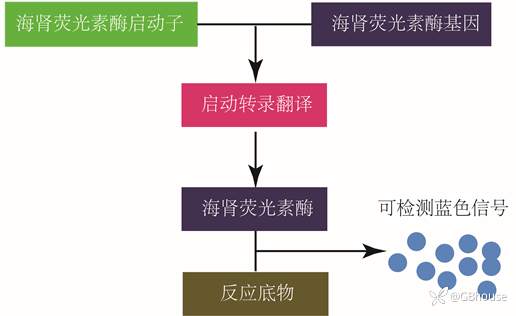
(图4 海肾荧光素酶的反应及信号检测)
2 双荧光素酶报告系统实验流程
2.1 双荧光素酶报告系统实验流程图
总体上来说,双荧光素酶报告系统实验只有四步,即1,构建重组报告基因质粒;2,工具/目的细胞铺板;3,荧光数据收集;4,数据统计分析。根据实验经验,最难做的是1,构建重组报告基因质粒。因此,为了更好的实验目的基因序列的扩增,一定要准备质量较高的模版(例如DNA,浓度,纯度,降解等都需要考虑进去)。
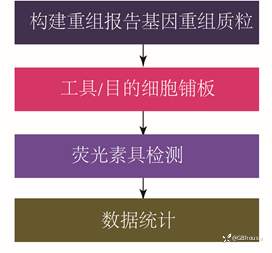
(图5 双荧光素酶报告系统实验流程图)
2.2 构建pGL3-Basic+基因重组质粒
双荧光素酶报告系统首先是构建报告基因系统,传统的是需要两个质粒,分别是报告基因重组荧光质粒(常见的是pGL3-Basic)和海肾荧光报告质粒(常见的是pRL-TK)。实验过程中,实验人员需要将自己感兴趣的基因片段(例如启动子 5’UTR/非编码RNA,例如miRNA (3’UTR),lncRNA (intergenic),ceRNA等)构建到pGL3-Basic中,得到含有目的基因的重组质粒。值得注意:在实验过程中需要用到优质的DNA片段,对于DNA的提取,请参考本公众号的推文《真核生物组织/体细胞与精子中DNA的提取-全方位知识囊括及实验操作》,把提取DNA的基本原理弄明白,有利于后续实验。海肾荧光报告质粒(pRL-TK)不做任何处理,只需要将pRL-TK与报告基因的重组质粒一起转染到工具细胞(例如293细胞)中即可。
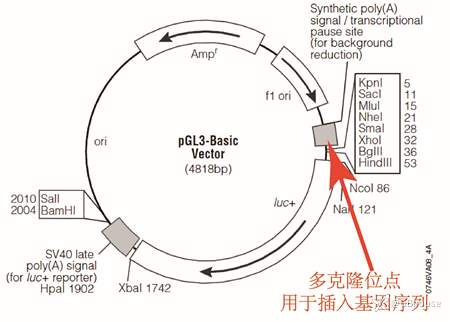
(图6 pGL3-Basic质粒图谱用于构建重组质粒报告基因质粒)
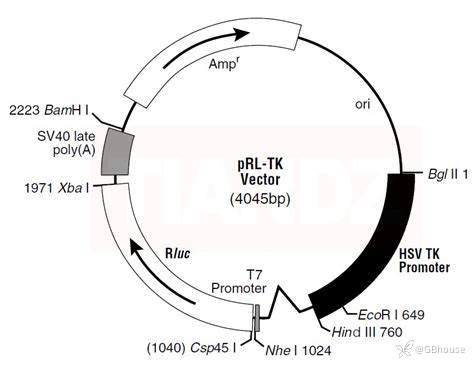
(图7 海肾荧光素酶报告基因质粒图谱)
当然随着科技的进步,现在已经有公司将pGL3-Basic和pRL-TK两个质粒整合到一个质粒中(pmir-GLO,一般来说主要用于miRNA的研究),只要将感兴趣的片段插入构建重组质粒,即可完成双荧光检测,得到实验结果。
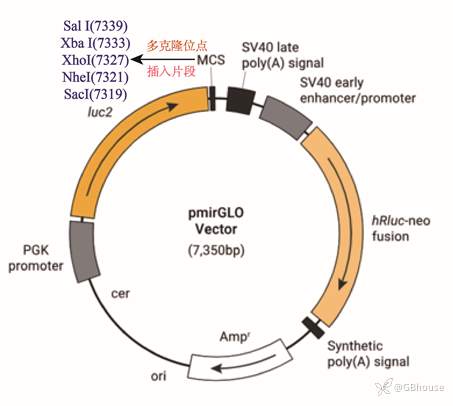
(图8 pmir-GLO质粒图谱)
2.3 细胞铺板与转染
细胞培养:细胞融合率达到 90%时进行传代培养,细胞铺板:取对数生长期的细胞制成细胞悬液,计数,接种于 24-well /96-well培养板中(细胞数量,根据细胞形态和生长能力大小而定),在铺板细胞细胞融合度达到约 50% - 60%,即可进行质粒转染工作(根据实验设计好实验组与对照组)。
2.4 荧光数据采集
在这里根据一般情况,描述实验步骤,具体步骤参考试剂盒说明书。
(a)取20 μL裂解液,加至培养板中。按照实验需要,可设置3孔-9孔重复,荧光数据一般不太稳定,建议多设计几个重复;
(b)配制萤火虫萤光素酶反应工作液和海肾萤光素酶反应液,即萤火虫萤光素酶底物(100 ×)和海肾萤光素酶底物(100×)。
(c)分别使用对应的缓冲液稀释至1×工作液,并孵育至室温。
(d)加入100 μL(具体参考说明书)萤火虫萤光素酶反应液,震板混匀,检测(波长550-570nm)萤火虫萤光素酶的活力,检测尽量在30 min内完成。
(f)加入100 μL(具体参考说明书)海肾萤光素酶反应液,震板混匀,检测海肾萤光素酶的活力,检测尽量在30 min内完成。
2.5 数据统计分析
将收集到的萤火虫荧光数值比上海肾荧光数值,即可得到感兴趣的报告基因的激活或抑制功能的定论。
3 常见问题及解决方案
3.1 启动子活性低(即萤火虫荧光数值/海肾荧光数值较小)
面对该问题主要考虑:1,细胞状态:优化细胞的培养条件,以及细胞状态进而提高荧光素酶的表达量;2,荧光信号衰减:荧光素酶的半衰期一般约30min,尽量避光条件下进行操作,且加完底物后立即检测,尽量在30min内完成数据采集。
关于荧光的问题-荧光值过高
3.2 荧光数值过高
荧光值过高可能会超出仪器检测范围,从而检测不到值,降低荧光值过高的问题主要通过以下方式尝试解决:1.减少质粒转染量;2.细胞样品裂解后,离心取上清后检测或对裂解产物进行稀释后检测;特别注意:不要延长检测时间,尽管数值降低,但是这是因为荧光素酶的半衰期到了,致使荧光数据降低,这样子的数值不能真是反应实验结果。
(爱自己!!!做科研!!! 每文格言诺贝尔文学奖得主加缪,47岁终年曾言:不要走在我后面,因为我可能不会引路;不要走在我前面,因为我可能不会跟随;请走在我的身边,做我的朋友。如果有用,关注楼主GBhouse,点赞+讨论,攻击性人格请请请不要关注和阅读!!!)
参考:
[1] Synthesis of active firefly luciferase by in vitro translation of RNA obtained from adult lanterns
[2] Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli
[3] Bringing MicroRNAs to Light: Methods for MicroRNA Quantification and Visualization in Live Cells
[4] In: Bioluminescence and Chemiluminescence: Current Status, eds.
















































