【大师兄带你读文献】之如何通过读文献提升科研思维和课题设计能力?实战篇系列2
前帖分享了如何通过读文献提升科研思维和课题设计能力?原则篇;
并带着大家首次完成了如何通过读文献提升科研思维和课题设计能力?实战篇
本帖大师兄将继续结合文献精读实例,带着大家精读解析一篇发在大子刊Cancer cell的文献,并从中提取科研思维和课题设计的借鉴之处!【建议重点读文末的研究思路解读】
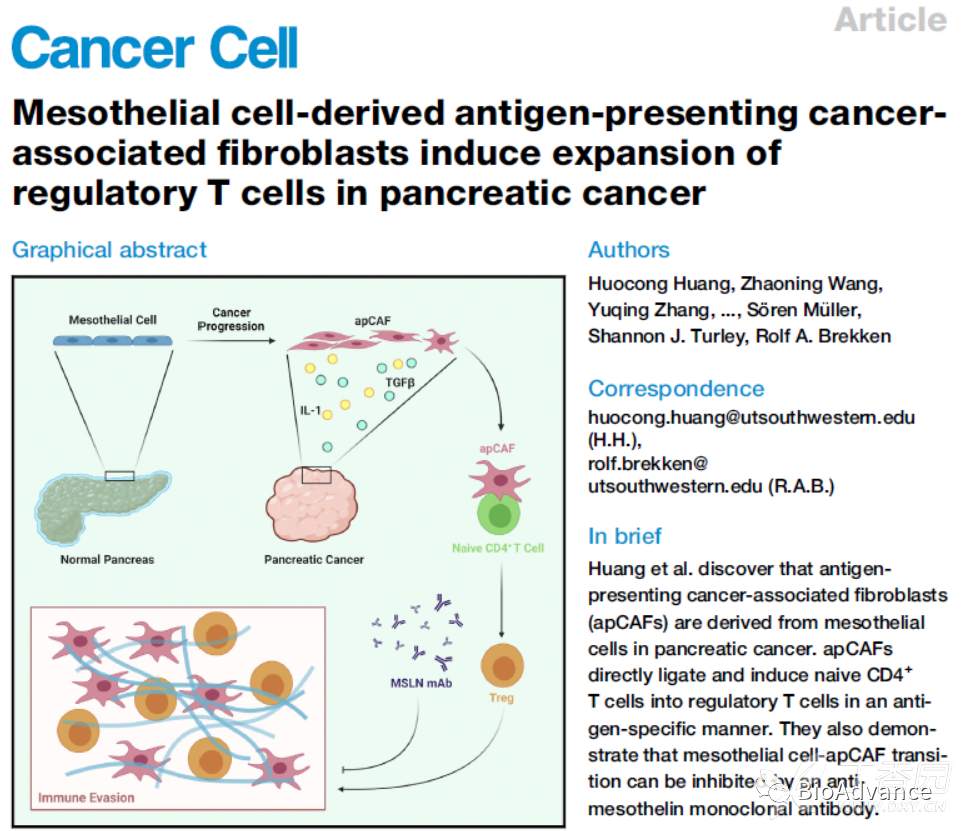
今天跟大家共同学习一篇2022年6月,美国德州西南医学中心Rolf A. Brekken团队发表在Cancer cell上的一篇研究论文。

该研究发现,胰腺癌肿瘤微环境中IL1和TGFb可以促进胰间皮细胞向抗原提呈CAF(apCAF)转化,apCAF进而促进naive CD4T细胞分化为Treg,产生免疫抑制,导致肿瘤细胞免疫逃逸。同时,临床前转化研究结果发现,通过单抗靶向间皮素可以阻断间皮细胞向apCAF转化,解除肿瘤免疫抑制,增强抗肿瘤免疫!
题目:
间皮细胞来源的apCAF(抗原提呈肿瘤相关成纤维细胞)诱导胰腺癌Treg扩增
研究背景:
已有文献表明:
- 胰腺癌对各种治疗反应低下,主要原因是肿瘤微环境由大量CAFs,髓系细胞等组成致密性免疫抑制性微环境;

- 胰腺癌组织中CAFs具有高度异质性,包括apCAF、iCAF和myCAF,为了进一步探讨胰腺癌中CAFs抑制性,本研究分别对正常小鼠胰腺、早期和晚期小鼠胰腺癌组织进行了单细胞测序,分析结果提示胰腺癌早期到晚期,间皮细胞和apCAFs具有类似的基因表达模式,提示apCAFs可能来源于间皮细胞;
- 间皮细胞具有分化潜能,在特定病理包括伤口愈合、脂肪形成、心肌梗死、腹膜纤维化、术后黏连和肝损伤等环境下,间皮细胞可以激活胚胎干细胞程序分化为间充质干细胞,可以分化为CAF等;
- 在肿瘤微环境中间皮细胞如何参与调控免疫微环境,尚不清楚;
- 多个已发表单细胞组学数据已经揭示apCAF存在于胰腺组织,可以通过MHCII与CD4发生相互作用;

本研究要解决的科学问题是:
胰腺癌微环境中间皮细胞和apCAF之间的关系及其在胰腺癌发生发展中的作用?
研究模型:
- Early KIC:40-day-old KrasLSL−G12D/+Ink4afl/flPtf1aCre/+(早期晚期小鼠胰腺癌模型、胰腺特异性KRAS激活突变+抑癌基因Ink4a缺失)
- Late KIC:60-day-old KrasLSL−G12D/+Ink4afl/flPtf1aCre/+(晚期晚期小鼠胰腺癌模型,胰腺特异性KRAS激活突变+抑癌基因Ink4a缺失,更容易转移)
- Late KPC:60-day-old KrasLSL−G12D/+Trp53LSL−R172H/+Ptf1aCre/+(晚期晚期小鼠胰腺癌模型,胰腺特异性KRAS激活突变+抑癌基因TP53功能缺失突变)
- Late KPfC:60-day-old KrasLSL−G12D/+Trp53fl/flPdx1Cre/+(晚期小鼠胰腺癌模型,胰腺特异性KRAS激活突变+抑癌基因TP53敲除)
- 他莫昔芬诱导型间皮细胞特异性(wt1介导)表达tdTomato小鼠模型;
- 小鼠原位注射胰腺癌原代细胞和间皮细胞模型;
- 体外OT-II CD4T细胞和胰腺癌各种免疫细胞共培养模型;
研究结果:
1.apCAFs来源于间皮细胞
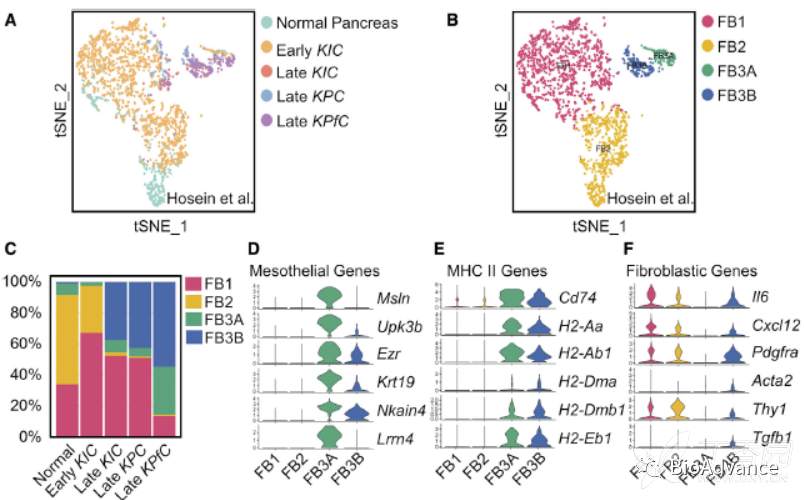
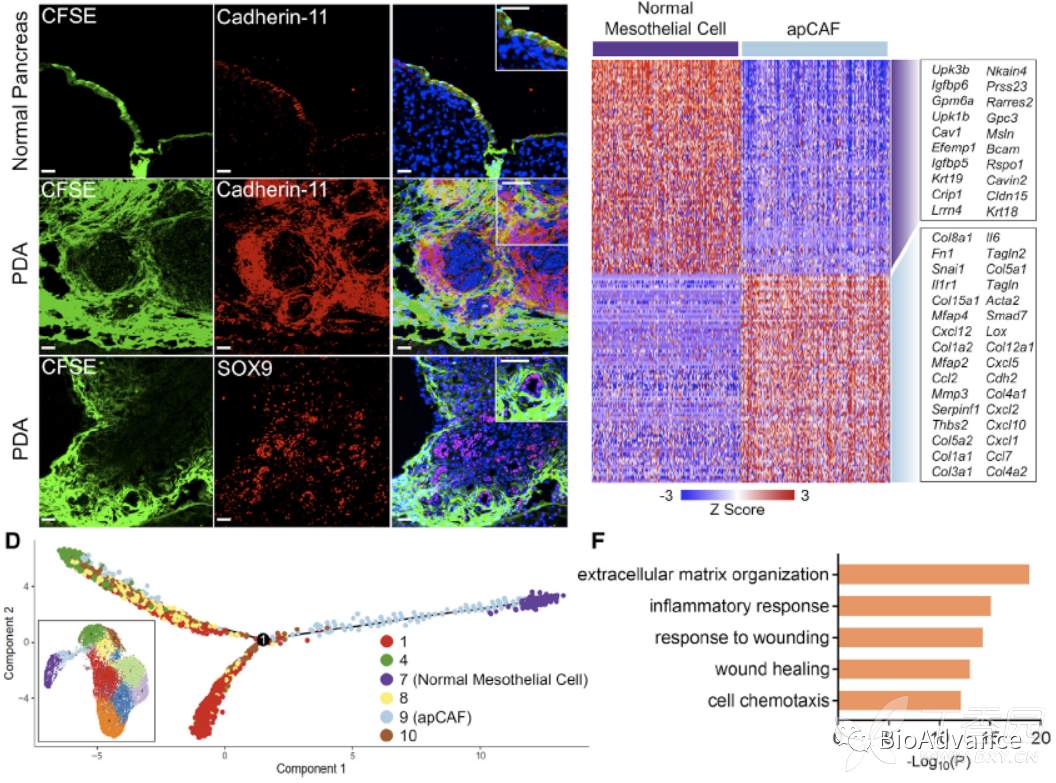
本研究团队在2019年发表在JCI insight的一篇文章,利用单细胞测序分析了正常胰腺、早期KIC,晚期KIC、晚期KPC、晚期KPfC肿瘤中的各类细胞抑制性,其中已经发现胰腺及胰腺癌中成纤维细胞可以分为三类:FB1、FB2、FB3(图A)。本研究在前期研究基础上,想要进一步探究胰腺癌进展中这些成纤维细胞亚群的关系及作用,于是继续对上篇文章单细胞数据中的成纤维细胞类群进行分析,通过t-SNE聚类(更适合亚群分类)发现FB3可以进一步细化分为FB3A和FB3B两群(图B),而且发现FB3B特异性在胰腺癌晚期富集(图C)。接着分析了单细胞数据中FB3A和FB3B的转录组特征,发现这两个亚群都表达MHC II相关基因(图E;Cd74, H2-Aa, H2-Ab1, H2-Dma, H2-Dmb1, H2-Eb1)和间皮细胞基因(图D;Msln, Upk3b, Ezr, Krt19, Nkain4, Lrrn4)。然而,与FB3A相比,FB3B亚群表达间皮细胞基因减少(图D),表达炎症和成纤维细胞特征基因增加(图F;Il6, Cxcl12, Pdgfra, Acta2, Thy1, Tgfb1)。基于以上结果,可以得知FB3A和FB3B都是间皮细胞,只是具有不同特征,其中FB3A属于正常间皮细胞,FB3B属于间皮细胞,但具有成纤维细胞特征。
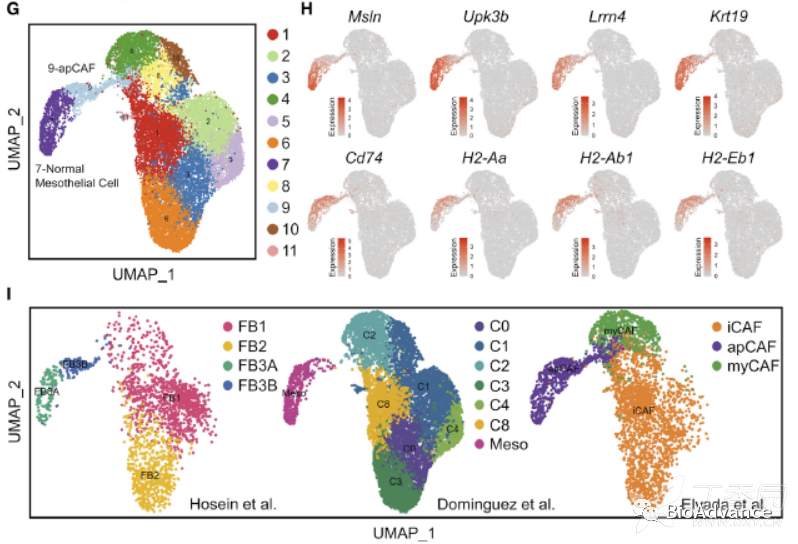
基于以上结果,为了进一步搞清楚这些间皮相关细胞(间皮细胞、成纤维细胞样间皮细胞)之间的关系,本研究整合了三个已发表小鼠胰腺癌组织单细胞数据集(1个是他们团队发表的,2个是其他团队发表的)。这三个数据集分别包含了间皮相关细胞FB3(Hosein et al.)、正常间皮细胞(Dominguez et al.)和apCAF(抗原提呈CAF;Elyada et al.)。将这三个单细胞数据集整合在一起,针对其中成纤维细胞进行UMAP聚类分析(更适合大样本聚类分析),发现成纤维细胞可以可以分为11亚类(图G)。为了鉴别间皮相关细胞,利用UMAP分析了MHC II基因和间皮细胞特异性基因在整合之后的成纤维细胞各亚群表达情况,发现cluster7主要表达间皮细胞基因集,cluster9主要表达MHC II基因集(图H)。进一步地,本研究将整合之后的成纤维细胞亚群拆分开来,放回到各自来源的参考文献中,并用对应参考文献的注释方法对亚群注释,Hosein et al.这篇文献将7群注释为FB3A,9群注释为FB3B;Dominguez et al.这篇文献将7和9群整体注释为间皮细胞;而Elyada et al.这篇文献则将7和9群整体注释为apCAF(图I)。以上结果表明FB3A和FB3B同时具有间皮细胞和apCAF的特征,考虑到FB3A表达更多间皮细胞基因,且不表达成纤维细胞(CAF)基因,因此定义FB3A为正常间皮细胞;相对应的,FB3B既表达抗原提呈MHC II基因,又具有CAF特征,因此定义FB3B为apCAF。既然FB3B定义为apCAF,同时FB3B又具有间皮细胞特征,而背景文献已经发现间皮细胞可以在特定条件转化为CAF,因此胰腺癌中的apCAF很可能来源于间皮细胞。
2.胰腺癌进展过程中间皮细胞扩增并导致致密间质形成
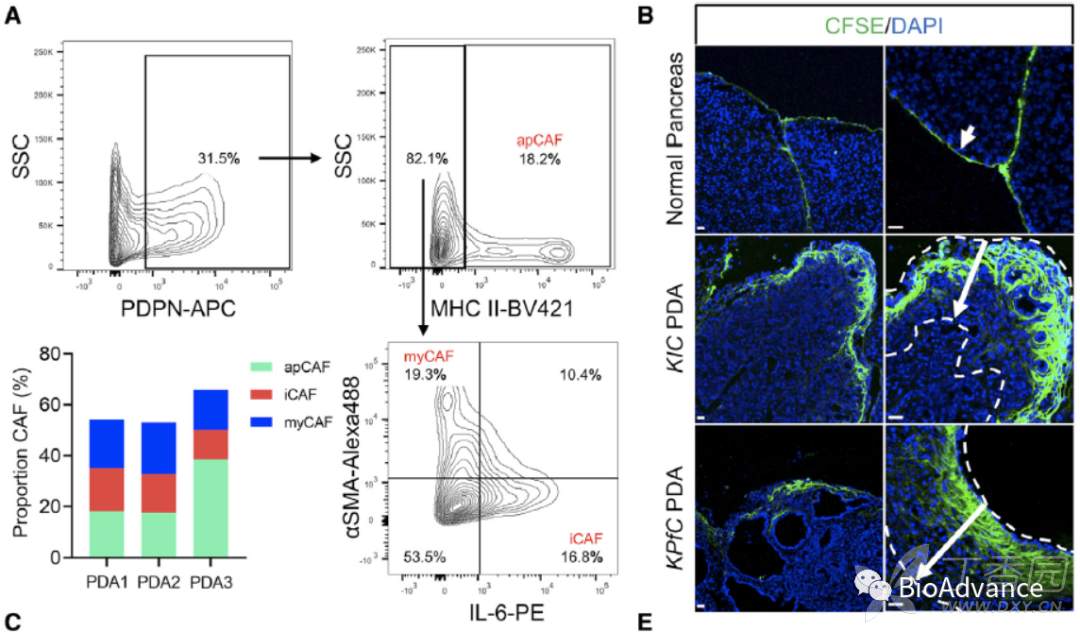
为了证明第一部分单细胞数据分析的结果,本研究首先对小鼠自发胰腺癌肿瘤组织进行流式分析,结果表明apCAF在胰腺癌进展中显著增加(图A)。接着,为了追踪间皮细胞在PDA(胰腺癌)进展中的作用,本研究利用CFSE染料特异性标记间皮细胞(已有报道),通过免疫荧光结果发现,在正常胰腺组织中间皮细胞仅存在于胰腺表皮,在KIC和KPfC胰腺癌肿瘤组织中,间皮细胞从间皮位置进入间质,出现显著扩增,从并形成致密间质结构(图B)。为了证明CFSE对间皮细胞的特异性标记,免疫荧光中加入Cadherin-11(间皮细胞表达)和SOX9蛋白(胰腺癌肿瘤细胞表达),结果表明CFSE特异性和Cadherin-11存在共定位,与SOX9无共定位。
3.创伤相关肿瘤旁分泌信号诱导间皮细胞向apCAF转变
已有研究报道,间皮细胞可以转化为CAF,本研究为了进一步探究在胰腺癌进展中间皮细胞如何向apCAF转变,首先进行了拟时序分析(针对正常间皮细胞、apCAF和CAF其他亚群),发现正常间皮细胞与apCAF进化轨迹紧密相接,而与其他类型CAF基本无关联(图D),这表明间皮细胞可以特异性转化为apCAP。这与作者在其他文章中证明的iCAF和myCAF主要来源于组织定居CAF的结论是一致的。接着,为了探究间皮细胞如何转化为apCAF,作者继续分析了单细胞数据,发现apCAF下调了很多正常间皮相关的基因,同时上调了另外一些基因,这些上调的基因很可能是决定间皮细胞向apCAF转变的关键。因此对这些apCAF中这些上调的基因进行了通路富集分析,发现主要富集在创伤修复和炎症相关通路,表明创伤相关通路参与了正常间皮细胞向apCAF的转变。
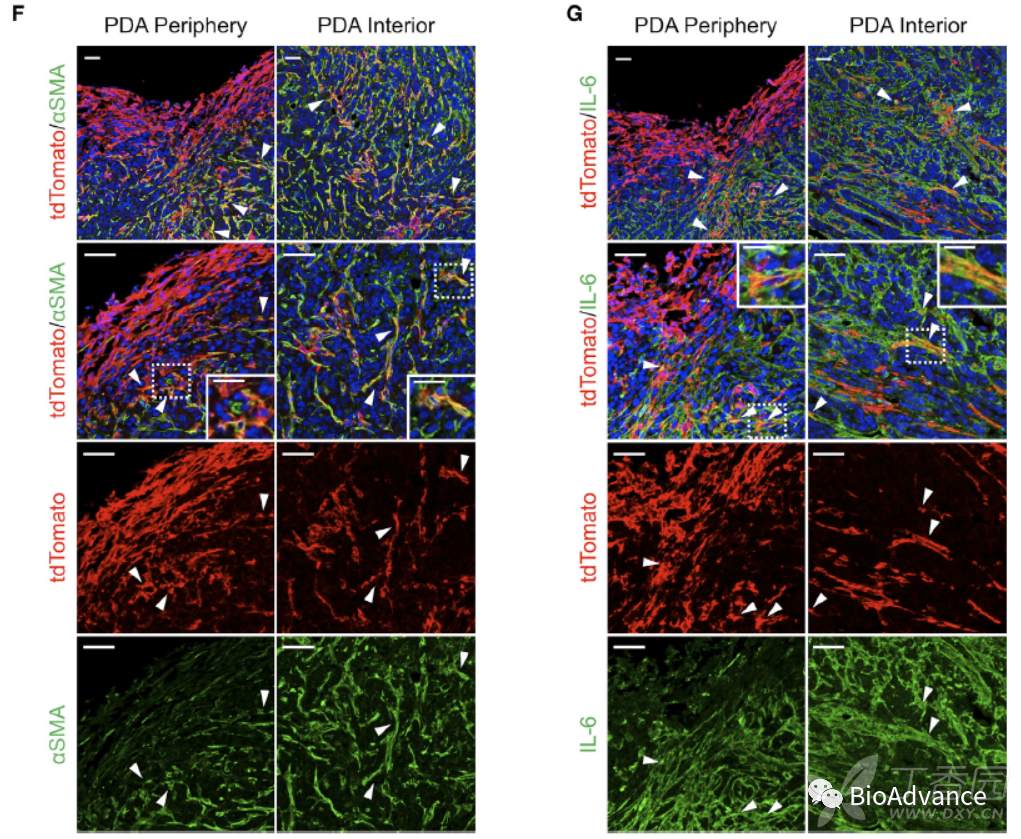
为了更直接证实正常间皮细胞向apCAF转变,本研究引入了间皮细胞特异性表达tdTomato的动物模型(图A;TAM:他莫昔芬诱导)。在该动物模型上,首先通过他莫昔芬诱导间皮细胞特异表达tdTomato,然后再进行胰腺原位成瘤(KPfC小鼠自发胰腺癌来源肿瘤细胞),21天后收样进行免疫荧光分析(图B)。结果表明,正常胰腺中间皮细胞显示红光,且并没有和CAF特征蛋白aSMA和IL-6共定位,说明正常间皮未向apCAF转化(图C和D),作为阴性对照,单独tdTomato(无wt1creERT2)小鼠中无红色荧光,证明tdTomato没有泄漏(图E)。而在原位瘤中可以看出,红色荧光出现在了肿瘤组织外周和内部,并且大量扩增形成致密间质结构,同时和CAF特征蛋白aSMA和IL-6明显共定位。以上结果充分证实,在胰腺癌中正常间皮细胞大量扩增,并且向apCAF转变。

4.间皮细胞在体外可重现向apCAF转变表型
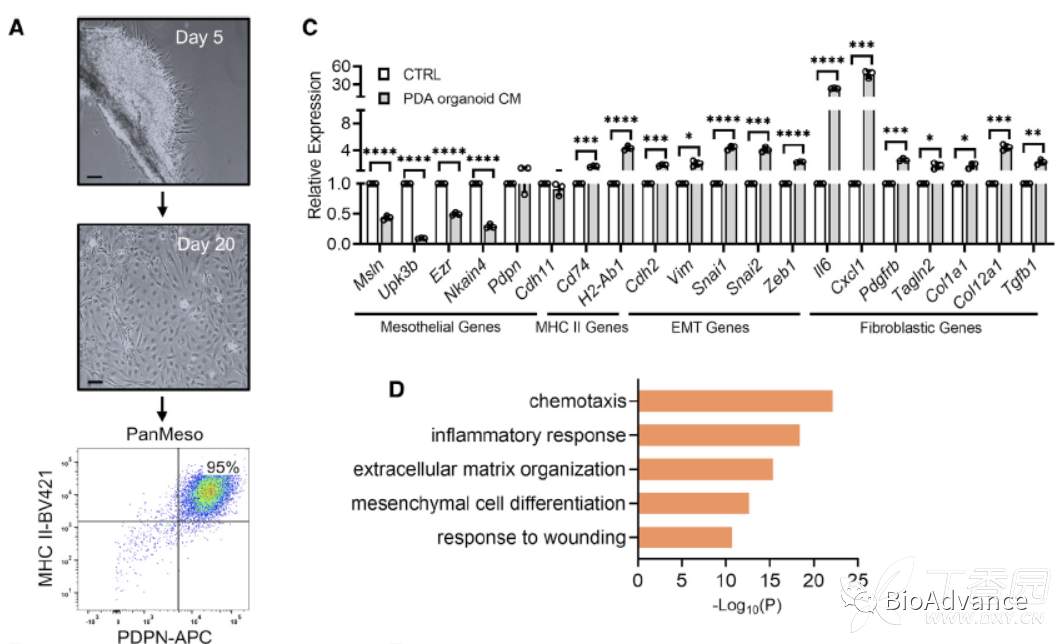
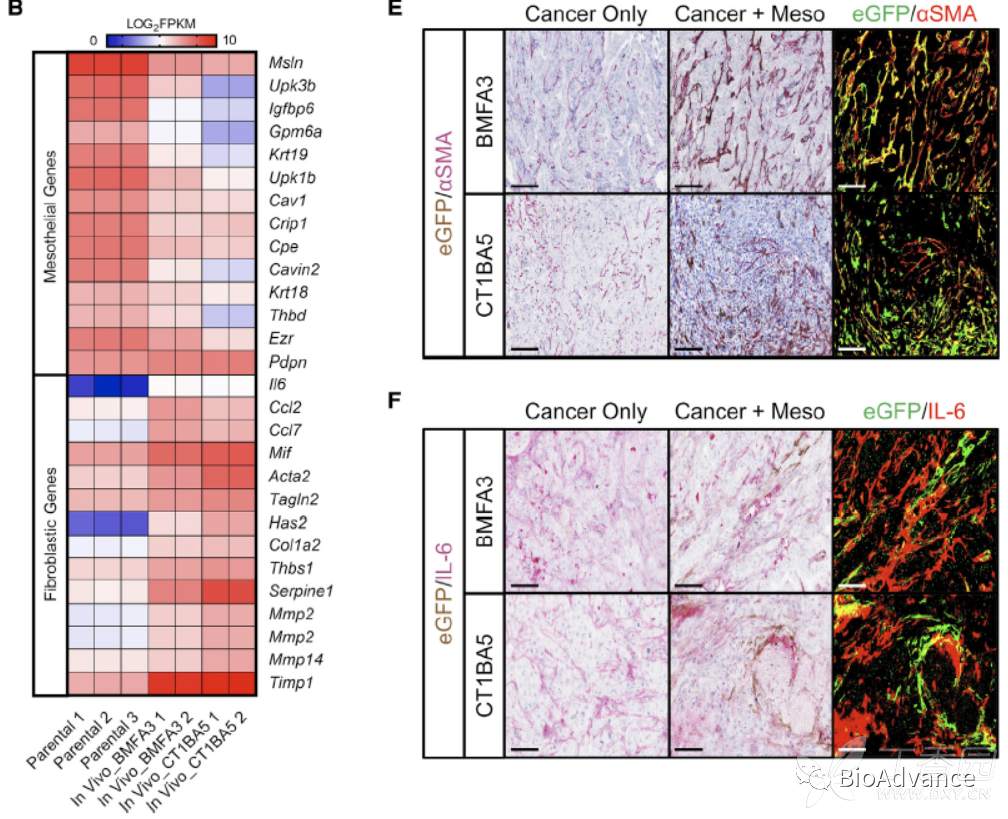
为了进一步证明间皮细胞是否通过肿瘤旁分泌途径转化为apCAF,作者在体外构建了小鼠间皮细胞细胞系(PanMeso),通过流式证明了细胞系构建成功,即同时表达间皮细胞特征性MHC II和PDPN(图A)。然后在体外,通过胰腺癌类器官的培养上清,刺激PanMeso,发现可以显著下调间皮相关基因、上调apCAF相关基因(MHC II和Fibroblastic genes)(图C)。接着在体内实验,本研究将PanMeso(eGFP标记)和小鼠胰腺癌原代肿瘤细胞混合进行原位成瘤,1月后,收集原位瘤组织,同时通过流式分选出eGFP阳性的PanMeso,对分选的细胞进行RNA测序,对比体外PanMeso的RNA seq结果,发现体内PanMeso间皮相关基因集显著下调,CAF相关基因集显著上调,(图B)。对体内PanMeso差异表达基因进行通路富集分析,结果提示同样是创伤和炎症相关通路显著富集(图D)。同时,收集到的肿瘤组织进行免疫荧光发现,PanMeso表型已经转变成为apCAF表型,特征表达aSMA和IL-6(图E和F)。综合体外、体内实验结果,证实肿瘤旁分泌途径诱导了正常间皮细胞向apCAF转变。
5.apCAF又到CD4 naive分化为Treg
既然在PAD过程中间皮细胞转化为apCAF,那么apCAF如何发挥作用呢?因为间皮细胞和apCAF是MHC II高表达,而MHC II直接作用于CD4 T细胞。所以本研究接着探究apCAF如何调控CD4 T细胞。因为apCAF虽然表达MHC II可以进行抗原提呈,但是其缺乏TCR共刺激分子(CD40/CD80/CD86等),因此为了探究apCAF和CD4 T细胞之间作用,利用OVA预处理apCAF,然后apCAF再与OT II CD4T细胞共培养(OT IICD4T细胞具有可以特异识别OVA的TCR)(图A)。本研究分别分离正常胰腺的正常间皮细胞、胰腺癌的APC、apCAF等细胞,以及类器官条件培养基处理的PanMeso,将这些细胞与OT II CD4 T细胞共培养(加或不加OVA),检测CD4 T细胞早期激活和向Treg转化marker水平,结果表明apCAF可以显著激活CD4 T细胞,并促进其向Treg转化。值得注意的是,正常间皮细胞在PDA类器官条件培养基处理转变为apCAF后其激活CD4T细胞及促CD4T细胞向Treg转化能力显著提高(图C-E)。那么这种apCAF诱导的Treg是否具有免疫抑制能力呢?接着将这种apCAF诱导的Treg和CD8共培养,利用CFSE标记检测CD8细胞增殖能力,结果表明apCAF诱导的Treg可以显著抑制CD8T细胞增殖能力。


6.apCAF在人胰腺癌病组织中存在且与Treg显著正相关
接着,本研究将以上发现在胰腺癌病人的组织样本中进行了验证。结果表明,人胰腺癌组织中apCAF存在(图A),且具有异质性(图B;病人中apCAF比列为0-35%)。一致的是,apCAF和Treg显著正相关,其他类型的CAF和Treg不相关。最后作者又引用两个其他已发表人胰腺癌单细胞数据,利用本研究中定义apCAF的signature基因对CAF各亚群进行了评分,结果证实本研究的apCAF和其他研究中的apCAF是属于同一类,也证实了apCAF在人胰腺癌组织样本中存在。

7.IL-1和TGFβ诱导间皮细胞向apCAF转变
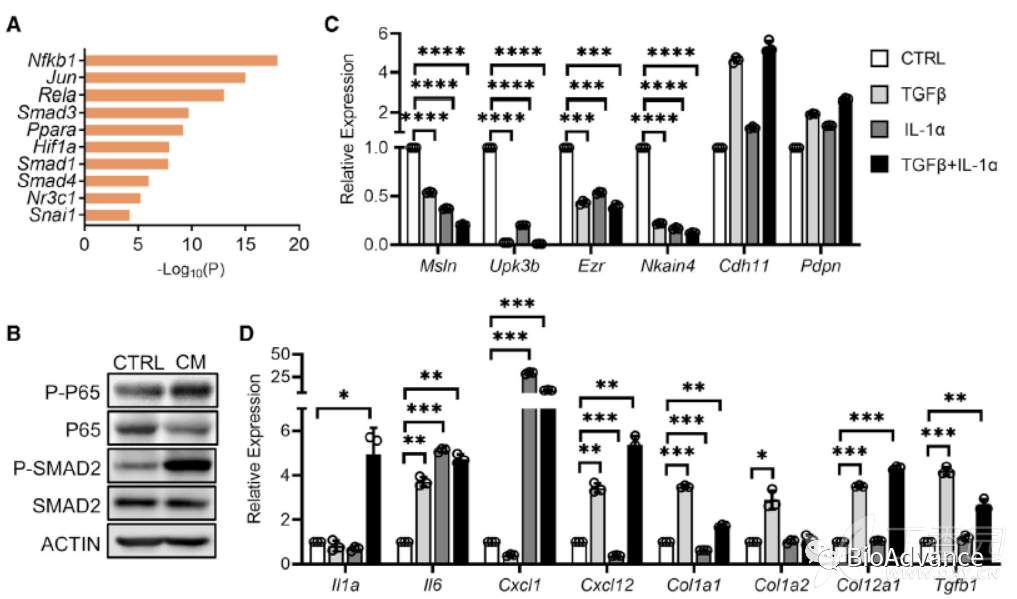
上文提到,肿瘤旁分泌途径诱导了间皮细胞向apCAF的转变,那么旁分泌中的哪种信号发挥作用呢?为了回答这个问题,本研究对整合单细胞数据中apCAF相对于正常间间皮细胞上调的基因进行了motif富集分析,找到了在apCAF中显著增强的转录因子中活性,显著富集的是NFKB信号(Nfkb1/Rela)和TGFβ信号(Smad1/2/3)(图A),这提示这两种信号很可能介导了正常间皮细胞向apCAF的转变。而IL-1可以显著激活NFKB信号,TGFβ可以显著激活TGFβ信号,因此IL-1和TGFβ这两种细胞因子很可能是通过旁分泌作用在正常间皮细胞诱导其向apCAF转变的关键。为了证实这一猜想,作者进行了体外实验,首先拿PDA类器官的CM(条件培养基)处理PanMeso,发现NFKB和TGFβ通路确实激活(图B)。接着在体外利用IL-1和TGFβ分别及联合刺激PanMeso,检测发现间皮相关指标显著下降(图C),而apCAF相关指标显著增强(图D)。体外共培养实验证实,IL-1和TGFβ单独及联合处理的PanMeso,确实可以激活CD4T细胞及诱导Treg转化(图E-H)。

8.正常间皮细胞向apCAF转化表型可以被抗间皮素抗体阻断
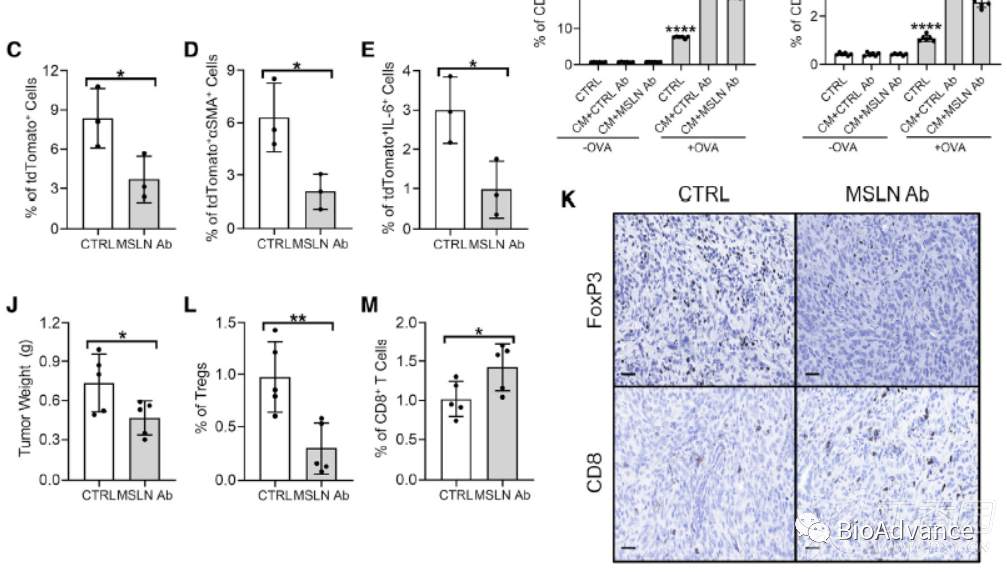
既然以上研究发现了PDA进展中正常间皮细胞被微环境中IL-1和TGFβ诱导向apCAF转化,并作用于CD4T细胞促进Treg转化发挥抗肿瘤免疫作用,那么是否可以通过靶向该机制轴,逆转正常间皮细胞向apCAF转化表型,从而增强抗肿瘤免疫呢?为了实现这一目的,基于之前文献报道抗间皮素抗体可以特异性阻断间皮细胞向CAF转变,本研究利用抗间皮素抗体处理,进行了体外体内实验。体外实验证实,抗间皮素抗体可以逆转PDA类器官CM诱导的正常间皮细胞特征基因下调及成纤维细细胞基因上调(图A、F、H),并且可以显著阻断CM处理间皮细胞诱导Treg分化的能力。体内实验tdTomato模型鼠进行小鼠胰腺癌原位瘤,证实该抗体可以显著抑制正常间皮细胞扩增及向apCAF转变,同时肿瘤重量降低,Treg减少,CD8T细胞增多(图B-E、J-M),表明增强了抗肿瘤免疫。

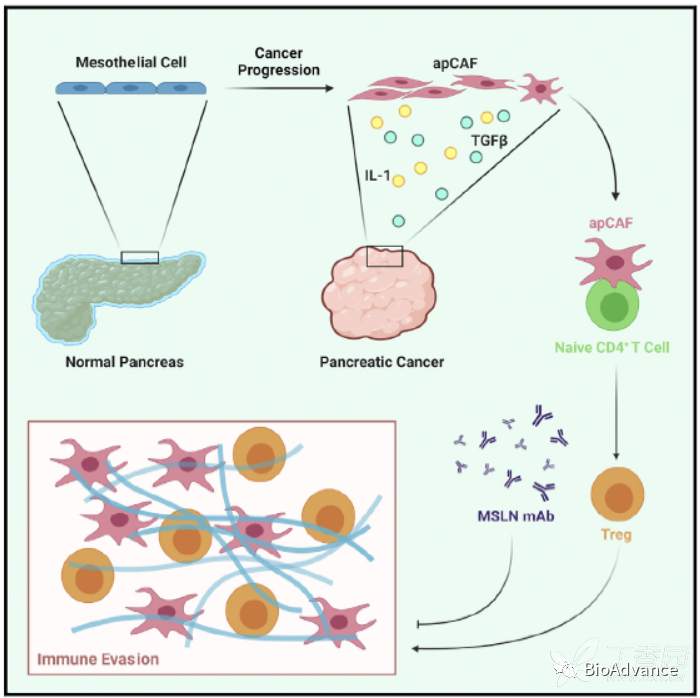
至此本研究完成了IL1/TGFβ---间皮细胞---apCAF---Treg---免疫抑制这一调控模式的证明。详细描述为:胰腺癌肿瘤微环境中IL1和TGFb可以促进胰正常间皮细胞向抗原提呈CAF(apCAF)转化,apCAF进而促进naive CD4T细胞分化为Treg,产生免疫抑制,导致肿瘤细胞免疫逃逸。基于以上研究结果发现,通过单抗靶向间皮素可以阻断间皮细胞向apCAF转化,解除肿瘤免疫抑制,增强抗肿瘤免疫。
研究思路解读
本研究以小鼠胰腺癌组织单细胞数据为出发点,首先整合胰腺癌多个研究单细胞数据集进行成纤维细胞亚群注释,发现对于同一群细胞,不同研究注释为不同细胞类型,即间皮细胞和apCAF,而背景研究可知间皮细胞可以实现向CAF的转化,这都提示胰腺癌中apCAF很可能来源于正常胰腺间皮细胞,本研究便以此为中心点,进行研究模式的设计。向下游找到正常间皮转化为apCAF之后如何发挥免疫抑制的,向上游找到了诱导正常间皮细胞向apCAF转化的细胞因子。这种单细胞数据整合分析,结合背景知识,提出一种细胞类型向另一种转化的思路非常值得借鉴。
1.为何选择间皮细胞向apCAF转化作为文章切入点?
胰腺癌中CAF分为iCAF、myCAF和apCAF,之前研究已经发现iCAF和myCAF来源于胰腺定居CAF分化而来,而对于apCAF的细胞来源尚未阐明,通过研究间皮细胞转化为apCAF,就回答了胰腺癌组织中apCAF的细胞来源问题,这也是本研究最大的创新点!
2.最终靶向为何选择靶向间皮素,而非IL-1和TGFβ?
既然本文阐明了,IL1/TGFβ---间皮细胞---apCAF---Treg---免疫抑制这一调控模式,在最后阻断间皮细胞向apCAF转化时,为何不直接靶向IL1和TGFβ?因为IL1和TGFβ具有广泛的功能,靶向该细胞因子对肿瘤细胞和其他免疫细胞都将产生影响,最终对免疫反应影响无法预估,而已有研究提示抗间皮素抗体可以阻断间皮细胞向CAF转变,而间皮素是间皮细胞特异表达,因此靶向该分子更具有特异性!
3.本文调控模式如何设计?
本研究提出IL1/TGFβ---间皮细胞---apCAF---Treg---免疫抑制这一调控模式是如何设计出来的?首先,文章出发点发现胰腺癌进展过程中,间皮细胞可以转化为apCAF,这是本文切入点及核心创新点;接着向下游走,apCAF发挥什么功能,apCAF是高表达MHC II的,MHC II是主要作用于辅助T细胞,即CD4T细胞,所以研究了apCAF对CD4T细胞功能的影响;而apCAF在胰腺癌进展中增多,提示可能发挥促癌作用,结果表明apCAF可以诱导CD4T向Treg分化,Treg发挥免疫抑制是已知的,这与apCAF在肿瘤中增多的促癌作用也是一致的,因此下游实现了逻辑串通;上游如何找到细胞因子IL1/TGFβ诱导间皮细胞分化为apCAF的呢?通过motif富集分析发现apCAF相对于正常间皮细胞差异上调基因显著富集在NFKB和TGFbeta通路,而又有结果提示肿瘤旁分泌信号介导了间皮细胞向apCAF的分化,旁分泌主要是细胞因子,而细胞因子中由IL-1和TGFbeta激活主要激活NFKB和TGFbeta信号,所以提示细胞因子IL1/TGFβ很可能诱导了间皮细胞向apCAF分化,接着实验也证实了这一猜想,至此上游逻辑通路也实现了串通。
注:未经授权本文禁止转载!
















































