思维导图!药品上市后变更法规及指导原则汇总-中药篇
为贯彻《药品管理法》有关规定,进一步加强药品上市后变更管理,国家药监局组织制定了《药品上市后变更管理办法(试行)》及一系列指导原则,本文对各类药品变更事项法规及指导原则做一简单梳理。
一、变更的分类
1、2020年01月22日发布的《药品注册管理办法》第五章药品上市后变更和再注册第七十七条规定:
药品上市后的变更,按照其对药品安全性、有效性和质量可控性的风险和产生影响的程度,实行分类管理,分为审批类变更、备案类变更和报告类变更。
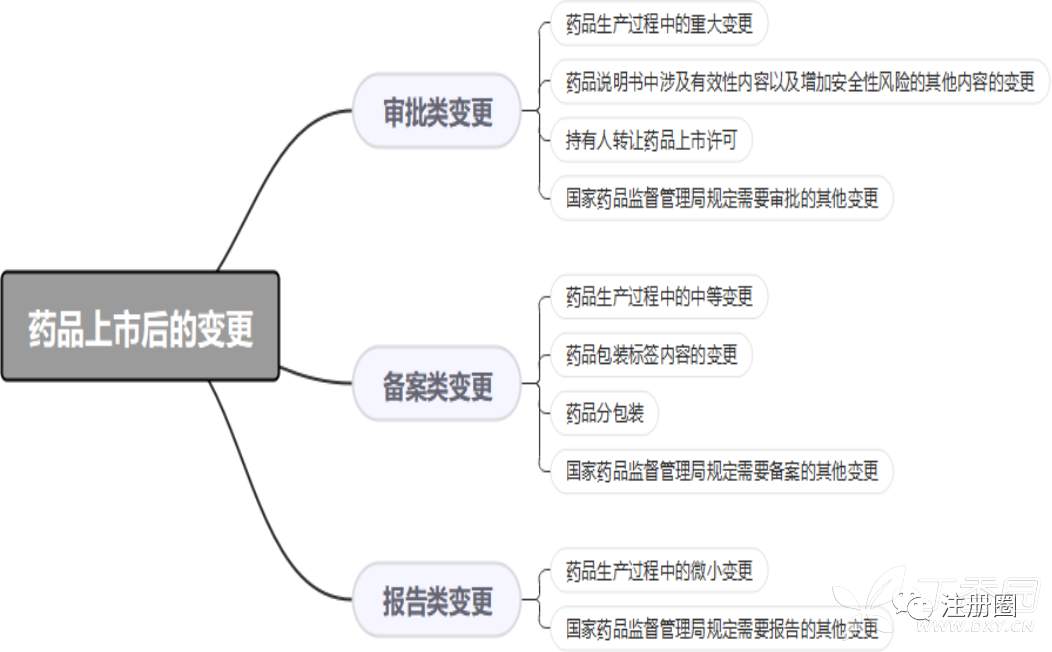
2、2021年01月13日国家药监局关于发布《药品上市后变更管理办法(试行)》的公告(2021年第8号)第一章总则第二条:
本办法所指药品上市后变更包括注册管理事项变更和生产监管事项变更。

二、按注册分类的指导原则
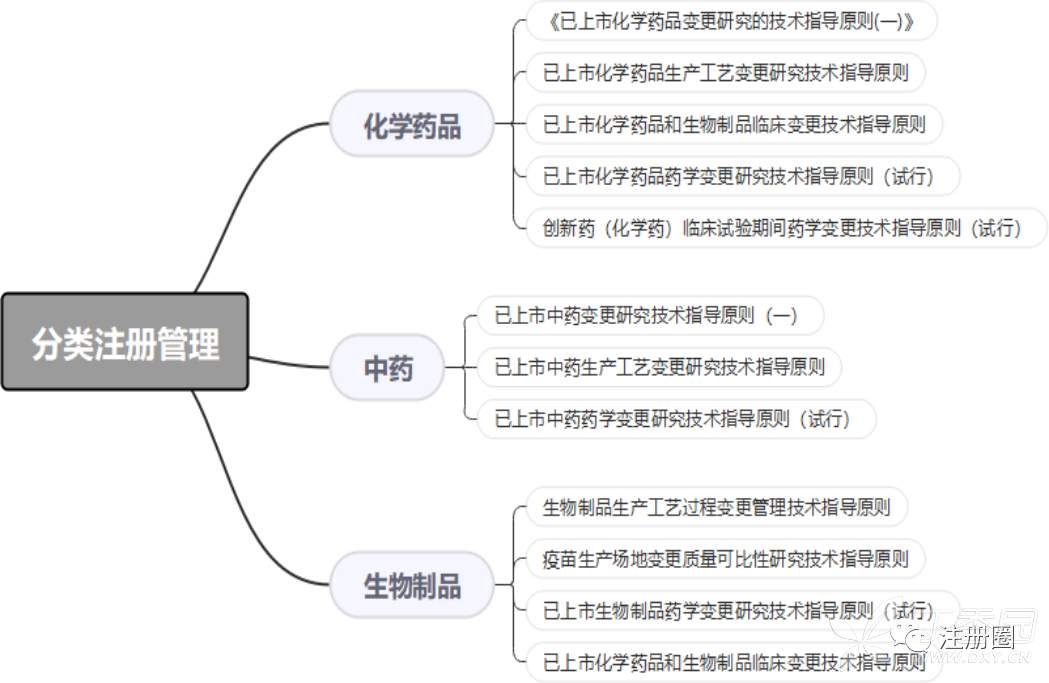
《药品注册管理办法》第一章总则第四条规定:药品注册按照中药、化学药和生物制品等进行分类注册管理。化药、中药、生物制品等相关变更事项的具体参考管理办法及指导原则汇总见下图:
三、中药类相关变更
1、变更分类
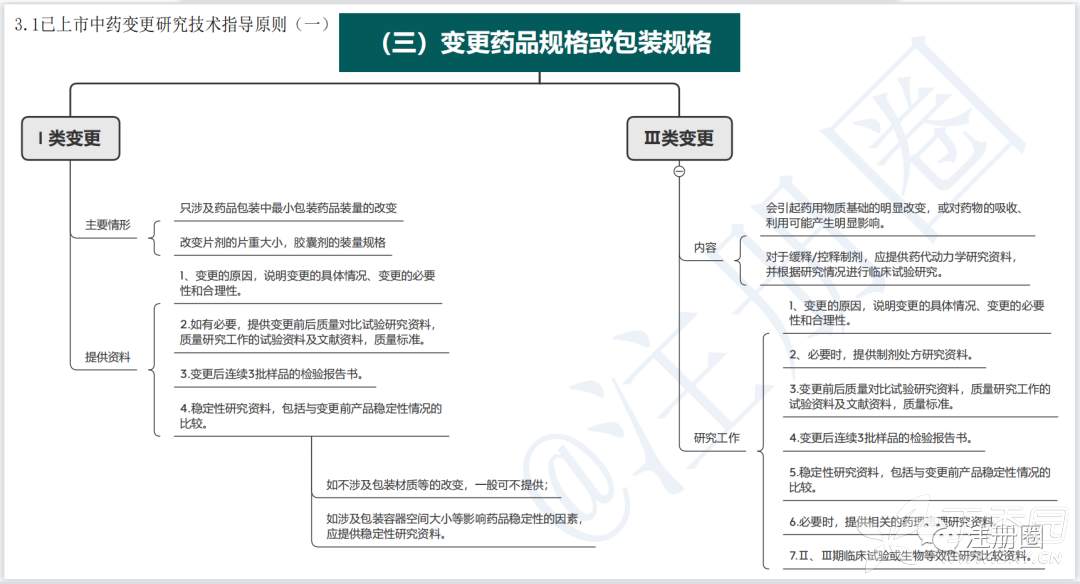
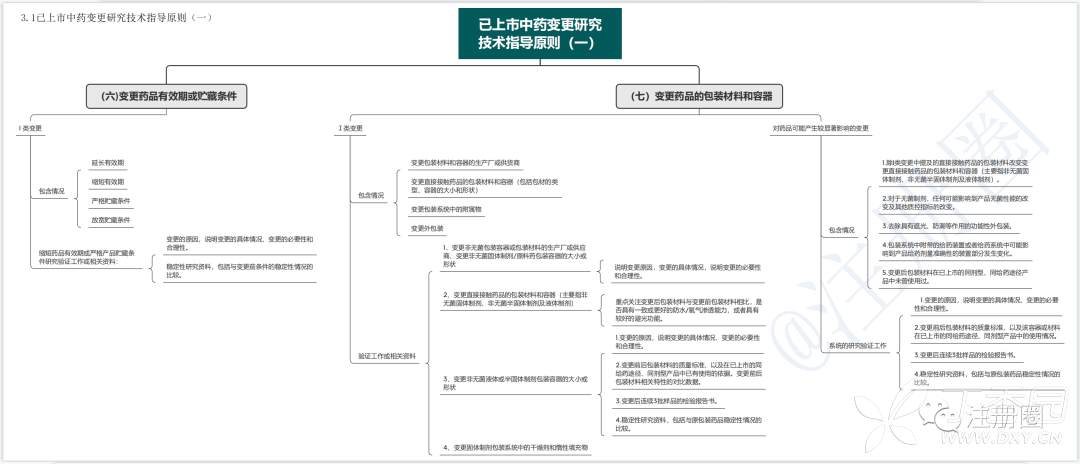
1.1已上市中药变更研究技术指导原则(一)
根据变更对药用物质基础或药物吸收、利用的影响程度,将所述及的变更划分为三类,内容见下表:

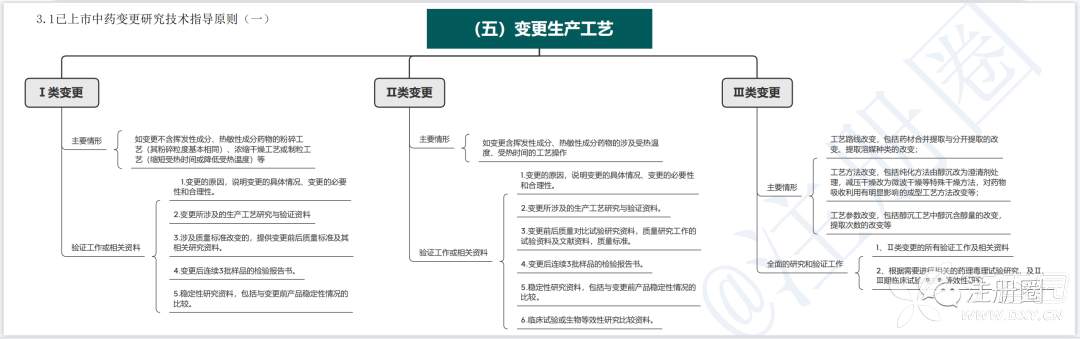
1.2已上市中药生产工艺变更研究技术指导原则
根据中药的特点,以及变更对药用物质基础或药物吸收利用的影响程度,工艺变更可分为三类,内容见下表:

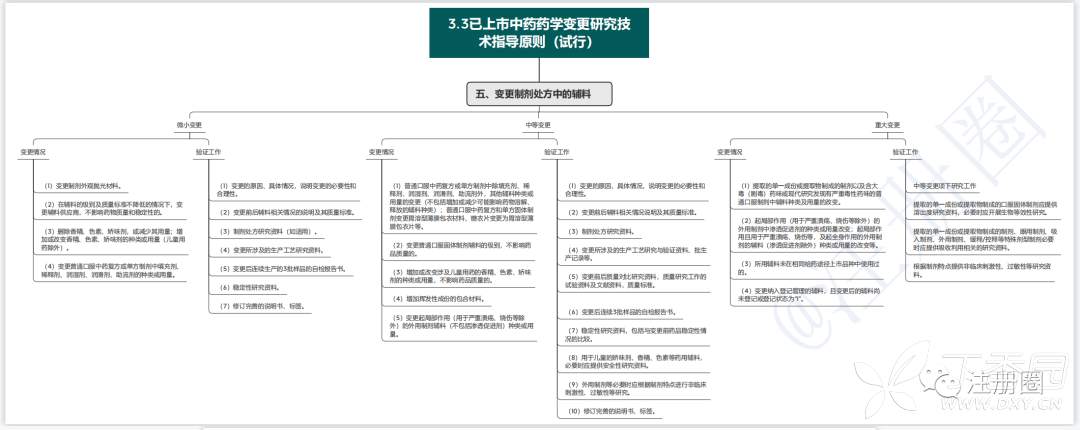
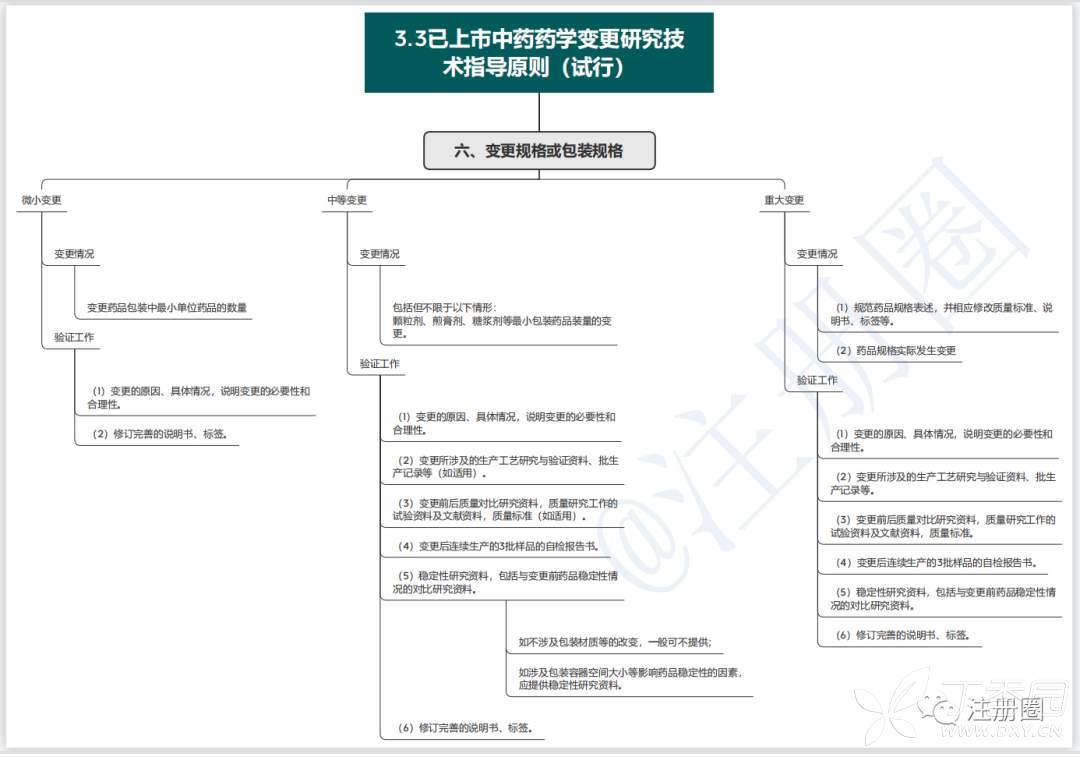
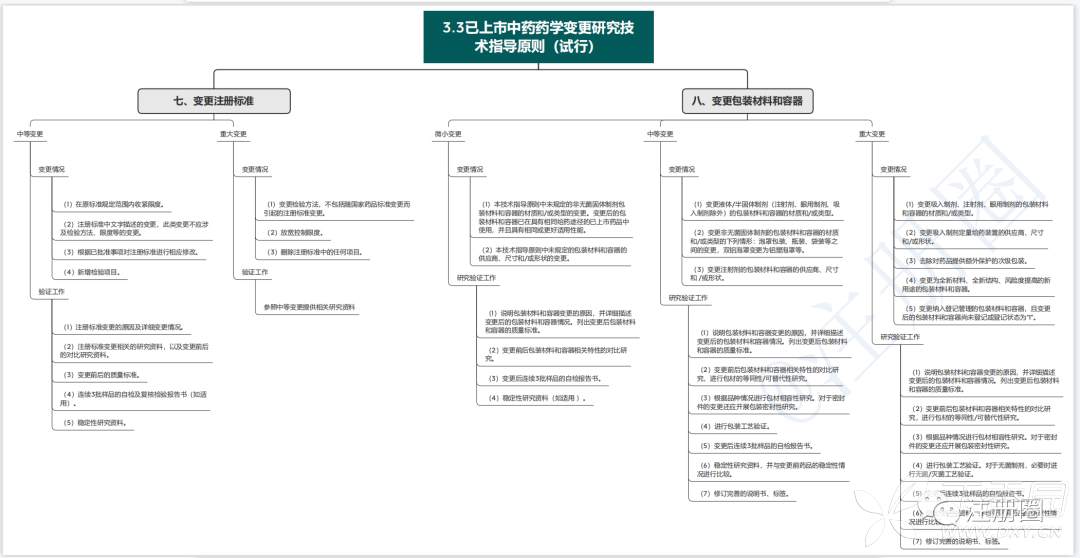
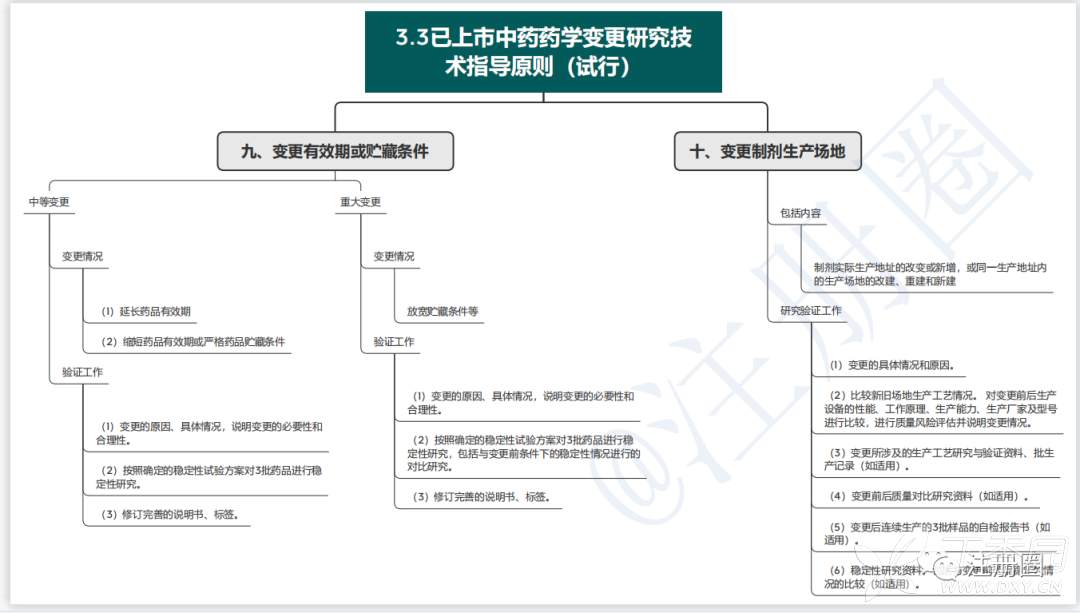
1.3已上市中药药学变更研究技术指导原则(试行)
药学变更分为微小变更、中等变更、重大变更三种。
2、变更内容
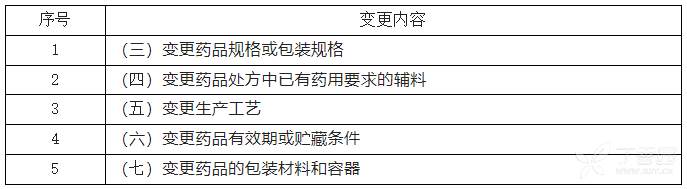
2.1已上市中药变更研究技术指导原则(一)
2.2已上市中药生产工艺变更研究技术指导原则

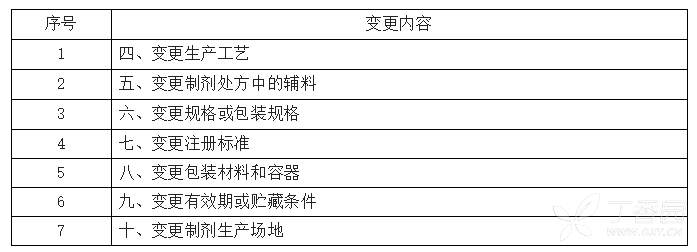
2.3已上市中药药学变更研究技术指导原则(试行)
3、思维导图



声明:本文转载来源于公众号【注册圈】,文章版权归原作者所有,如若违规,请版主删除。
















































