TNFR信号通路系列之二:RIP家族
TNFR信号通路系列之二:RIP家族
一、RIP家族
1995年,Stanger BZ通过酵母双杂交首次发现了一个与Fas相互作用的蛋白,因而命名为受体相互作用蛋白(receptor-interacting protein,RIP),随着RIP家族成员的增多,它被称为RIP1[1]。
RIP 家族成员均有一个同源的丝氨酸-苏氨酸激酶结构域,具有激酶和非激酶的作用,因此具有激酶作用的 RIP 又被称为受体相互作用蛋白激酶(receptor-interacting protein kinase,RIPK)。目前临床上发现RIP家族共7个成员,分别为RIP1~7[2,3]。
RIP1~7的N末端结构具有高度同源性,激酶结构域具有相似性,提示RIP1~7蛋白家族成员可能具有某种相同或者相似的生物学功能。而RIP1~7家族的中间结构、C端结构之间存在一定的差异[2]。
- RIP1:DD-RHIM-ID。RIP1 的C端结构含有一个死亡结构域 (death domain,DD),但是中间结构则包含一个RIP同型结构域 (a RIP homotypic interaction motif,RHIM)和一个与相互连接的中间域(a bridging intermediate domain,ID);
- RIP2:CARD-ID。RIP2 的C端结构则含有一个caspase募集域(caspase recruitment domain,CARD),但是其中间结构仅包含有一个ID;
- RIP3:RHIM。RIP3比较特别,其C端结构是RHIM,且缺少中间结构域;
- RIP4 和 RIP5:AD-ID。RIP4 和 RIP5 的C端结构都是锚蛋白域(ankyrin domains,AD),但是其中间结构则是ID;
- RIP6 和 RIP7 的结构与其它 RIP 家族成员相关性较弱。除了包含 RIP 家族共有的激酶结构域和锚蛋白重复序列,还包含一些其他结构域,如富含亮氨酸重复序列和 WD40 重复序列[3]。
1、RIP1的结构和功能[2]
(1)RIP1 中间域(ID)的 Lys377 是泛素分子 Lys63 介导的一个重要的泛素化 RIP1 位点。RIP1位点发生泛素化后,Lys377可以与其他泛素受体蛋白相结合并形成复合体,此时 RIP1 能够与 NF-κB 结合发生转录,并通过这种方式调节人体细胞的生存状态。
(2)RIP1上的RHIM,可与其他含有RHIM蛋白或相关因子的家族成员(如RIP3、IFN-β、TRIF、DAI[3])进行相互作用。RIP1 能够与 RIP3 中的 RHIM 相互作用,并形成一个丝状淀粉样结构,且这一结构对调节人体中的坏死性凋亡(necroptosis)机制具有决定性作用。
(3)RIP1 死亡结构域(DD)是 6 螺旋折叠的结构状态,而这种 6 螺旋折叠结构在 TRADD(TNFR1 associated death domain protein,TNFR1相关死亡结构域蛋白)和 FADD(Fas-associated death domain protein,Fas相关死亡结构域蛋白)中同样存在。
2、RIP1的调节
RIPK1 的两个重要方面是 RIPK1 的泛素化状态和激酶活性[11]。
- RIPK1 的多泛素化状态决定了其发挥抗凋亡(复合体Ⅰ中的泛素化RIP1)或促凋亡(复合体Ⅱb中的去泛素化RIP1)作用。
- RIPK1 的激酶活性对其促进 caspase-8 激活复合物形成和随后的细胞凋亡的能力至关重要(复合体Ⅱb),但对于 NF-kB 激活是可有可无的(复合体Ⅰ)。
(1)RIP1的泛素化[1-3]
- 在 TNF-α 诱导下,RIP1 的 Lys377 是其功能性的唯一结合泛素化位点,在激活 NF-κB 活性中是必需的;
- RIP1 的 Lys63 位点的泛素化促进了其下游 NF-κB 的激活;
- 但是,RIP1 的 Lys48 位点可被锌脂蛋白 A20 泛素化引起 RIP1 的降解,抑制 RIP1 诱导的 NF-κB 的激活。
(2)RIP1的去泛素化
RIP1 的 Lys63 位点被 TRAF2 泛素化后,RIP1 就可以结合到 TNFR1 复合物上。随后,锌脂蛋白 A20 通过其 N 端的去泛素化结构域移去 RIP1 的 Lys63 位点上连接的泛素链,A20 的 C 端泛素连接酶在 RIP1 的 Lys48 连接上蛋白水解酶所识别的泛素链,使 RIP1 最终被降解[1]。
(3)RIP1/RIP3
RIP3 含有与 RIP1 相似的 N 端激酶结构域和 C 端 RHIM 基序。RHIM 可与具有相同结构的蛋白(RIP1、TRIF、IFN、DAI)相互作用。
RIP3 与 RIP1 结合,RIP3 可磷酸化 RIP1,但 RIP1 不能磷酸化 RIP3。磷酸化的 RIP1 抑制 NF-κB 的激活[1,3]。
(4)热休克蛋白90(Hsp90)
Hsp90 在维持 RIP1 的稳定性和可溶性方面发挥着重要作用[1]。Hsp90 能够促进 RIP1 的调控,其功能受到抑制会影响 RIP1 功能的发挥及其应对TNF刺激时下游信号的转导[3]。
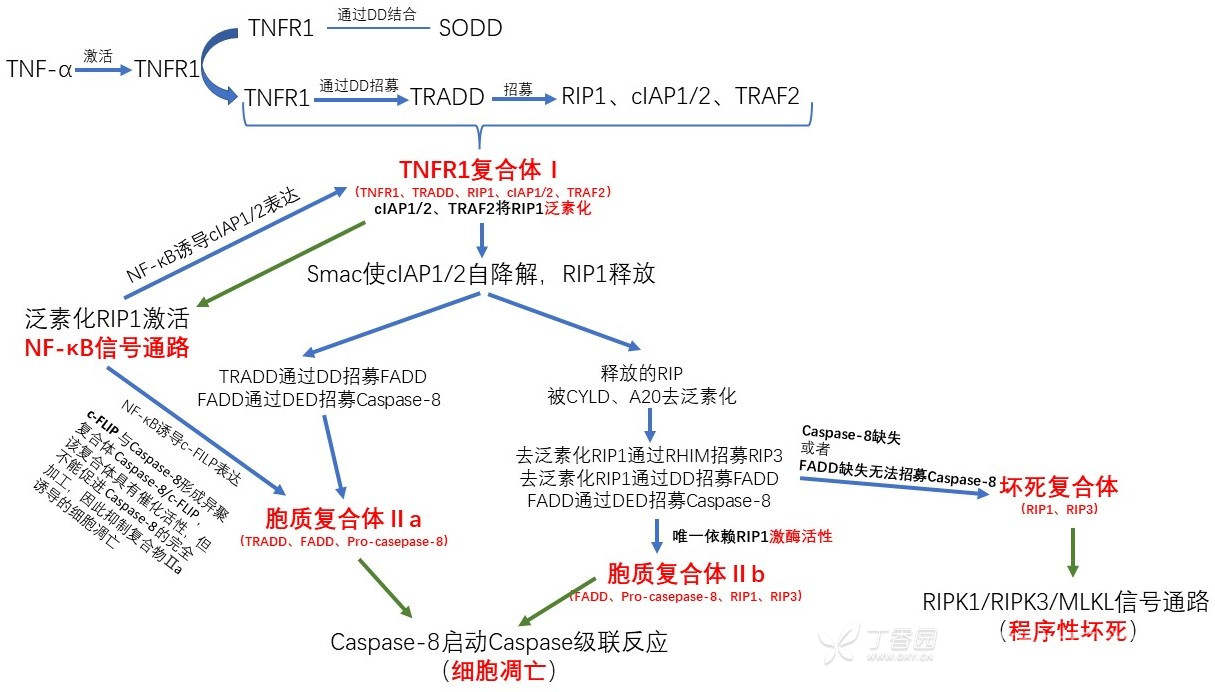
二、TNFR1复合体Ⅰ(NF-κB信号通路)
TNFR1、TRADD、TRAF2、RIP1、cIAP1/2共同形成TNFR1复合体Ⅰ。复合体Ⅰ装配完成后,RIP1被快速多聚泛素化,该过程对于 IKK 复合物的募集和NF-κB的活化都是必要的。TNFR1复合体Ⅰ的形成过程见帖子:TNFR1相关复合体。
(1)RIP1泛素化
TRAF2、cIAPs 可作为 E3 泛素连接酶[9],与LUBAC(liner ubiquitin chain assembly complex,线性泛素链组装复合体)[2,3,7,9]一起在 RIP1 上形成 K63 或 K11 多聚泛素链[3,9,11]。RIP1 的泛素化对于 NF-κB 的激活是必要的。
(2)NF-κB信号通路的激活
多泛素化的 RIP1 能够与 TAK1(TGF-β-activated kinase 1,TGF-β激活激酶1) 信号通路、TAB2/3 (TAK1-binding proteins)信号通路相结合[3,9]。结合后 TAK1 信号通路和 TAB2/3 信号通路能够磷酸化 MEKK3(MEKK3见帖:MAPK信号通路) [3]。MEKK3 使 PIR1连接到 IKK 上。RIP1 通过 ID 结合 IKK 的调节亚基 NEMO,从而激活 IKK,进而激活 NF-κB信号通路[1-3,5,6,9,10]。NF-κB信号通路见帖:NF-κB信号通路。
NF-κB信号可诱导抑制凋亡蛋白基因转录而负向调节凋亡,包括 cIAP1/2、c-FLIP、Bcl-2 家族[3,10,11]。
(3)JNK信号通路的激活
TRAF2 和 RIP 还可以直接或间接地活化 MEKK1(MEKK1见帖:MAPK信号通路),MEKK1 可激活 JNK 信号通路,使细胞色素(Cyt-c)释放(即通过线粒体介导通路导致细胞凋亡)[8]。
三、胞质复合体Ⅱ中的RIP1(细胞凋亡)
Smac 使 cIAP1/2 自降解,随后 TNFR1复合体Ⅰ从质膜上解离,转移至胞质内。RIP1从复合体Ⅰ中释放,剩余适配蛋白形成了胞质复合体Ⅱa,而被释放的RIP1去泛素化形成了胞质复合体Ⅱb。胞质复合体Ⅱa 或 Ⅱb 的形成见帖子:TNFR1相关复合体。
(1)Caspase级联反应
胞质复合体Ⅱa 和 Ⅱb 均含有 FADD 和 Pro-caspase-8。Pro-caspase-8 是由 FADD 通过 DED 相互作用募集而来(DED位于 Caspase 的 prodomain 结构域)。胞质复合体Ⅱa 和 Ⅱb 通过 Caspase-8 发出细胞凋亡信号,激活下游的 Caspase-3 和 Caspase-7,启动外源性凋亡[3]。Caspase级联反应见帖:Caspase级联反应。
(2)RIP1片段
RIP1在 天冬氨酸324 被 Caspase-8 剪切,产生2个片段。其中 C 端片段包含完整的 DD 和大部分 ID,可增强 TNFR1 与 TRADD、FADD 的结合,进一步活化 Caspase-8,诱导细胞凋亡,且诱导凋亡能力强于全长的RIP1[1,9]。
四、坏死复合体(坏死性凋亡,又称程序性坏死)
通过RIPK1/RIPK3/MLKL信号通路引起坏死性凋亡。

1、RIPK1/RIPK3
(1)RIPK1招募RIPK3
胞质复合体Ⅱb 形成过程中,RIP1 去泛素化后,若 caspase-8 或 FADD 缺失,RIP1 与 RIP3 中的 RHIM 相互作用,形成坏死复合体[3]。RIP1和RIP3在诱导坏死性凋亡过程中发挥其激酶作用,因此又被称为 RIPK1 和 RIPK3。坏死复合体的形成见帖子:TNFR1相关复合体。
(2)RIPK3磷酸化
RIPK3 激酶结构域可发生自身磷酸化。磷酸化的 RIPK3 激活 MLKL[3]。
- RIPK1 和 RIPK3 的激酶结构域均可发生自身磷酸化[1,10]。RIPK3 与 RIPK1 结合,RIPK3 可磷酸化 RIPK1,但 RIPK1 不能磷酸化 RIPK3。磷酸化的 RIPK1 抑制 NF-κB 的激活[1]。
- RIPK3 去磷酸化可抑制细胞坏死性凋亡的发生[3]。
2、MLKL
(1)MLKL结构
MLKL (mixed lineage kinase domain like protein,混合谱系激酶结构域样蛋白)由一个 N 端卷曲螺旋结构域和一个 C 端假激酶结构域组成,空间构象为一个与假激酶结构域相连的四螺旋束[9]。
- N 端螺旋束对于 MLKL 的寡聚化很重要
- C 端为典型的激酶样折叠。但与经典激酶不同,MLKL 在催化环的HRD基序中缺乏典型的Asp,在 DFG基序中缺乏负责Mg2+协调,被称为假激酶结构域。因此 MLKL 尽管能够结合 ATP,但 MLKL 没有催化活性。
(2)MLKL磷酸化
MLKL 是 RIP3 的下游靶标,激活的 RIP3 招募 MLKL 并将其磷酸化(人MLKL激酶样结构域的 Thr357/Ser358 位点,小鼠 MLKL 的 Ser345/347/352 和 Thr349 位点)。RIP3 介导的 MLKL 磷酸化触发其构象变化,导致 MLKL 的 N 端四螺旋束暴露,进而导致 MLKL 三聚化,形成磷酸化的三聚体[3,9,10]。未被激活的 MLKL 以单体形式存在于胞质中[10]。
(3)成孔复合体
MLKL 三聚体可以结合磷脂酰肌醇磷脂(phosphatidylinositol phosphate lipids,PIPs)和线粒体特异性的心磷脂(cardiolipin,CL),使 MLKL 与膜结合并将其 N 端插入各种细胞器和质膜。MLKL 三聚体作为成孔复合体,直接导致细胞坏死性膜破裂[3,9,10]。
3、坏死性凋亡特点[12]
尽管程序性坏死(Necroptosis)与细胞凋亡存在共同的上游分子,但是两者结果不同,程序性坏死对组织稳态的破坏性更大。
- 细胞凋亡通过线粒体凋亡途径,而坏死性凋亡可以独立于线粒体进行[9]。
- 与细胞凋亡相比,程序性坏死不引发核固缩,染色质不会凝聚,不伴有线粒体细胞色素 C 释放,不产生核小体 DNA 片段。程序性坏死主要特征是线粒体功能障碍,线粒体膜电位缺失,细胞器及细胞肿胀破裂,膜完整性被破坏,细胞内含物漏出。
部分细胞内含物将作为DAMPs进入周围组织,引发周围组织的反应 (如炎症反应等)。
- DAMPs (damage associated molecular patterns,损伤相关分子模式)指机体自身细胞死亡所释放的内源性危险分子。目前研究最多的 DAMPs 包括高迁移率组蛋白B1(high mobility group box-1 protein,HMGB1),热休克蛋白 (HSP),IL-1 等, 这些分子可以对周围组织造成进一步破坏效应。
此外,细胞内容物还可以导致自噬溶酶体活化,部分坏死细胞的活性氧(ROS)浓度增加。
============
参考文献
[1]李莉,闫言.受体相互作用蛋白激酶RIP1在细胞信号传导途径中作用的研究进展[J].基础医学与临床,2011,31(10):1165-1167.DOI:10.16352/j.issn.1001-6325.2011.10.009.
[2]李承宗.RIP1与TNF-α诱导信号通路关系的研究进展[J].中国卫生标准管理,2019,10(19):66-69.
[3]魏敏,闫言,李莉,王宝玺.受体相互作用蛋白1和受体相互作用蛋白3在细胞信号转导通路中的作用[J].医学综述,2021,27(16):3154-3159.
[4]Wang L, Du F, Wang X. TNF-alpha induces two distinct caspase-8 activation pathways. Cell. 2008 May 16;133(4):693-703. doi: 10.1016/j.cell.2008.03.036. PMID: 18485876.
[5]丘创华,侯敢,黄迪南.TNF-α信号传导通路的分子机理[J].中国生物化学与分子生物学报,2007(06):430-435.DOI:10.13865/j.cnki.cjbmb.2007.06.002.
[6]叶嘉杰,姚啸生,戚晓楠,郑浩,于红卫,路翀.NF-κB信号通路在椎间盘退行性变中的机制研究探讨[J].沈阳医学院学报,2022,24(02):169-173.DOI:10.16753/j.cnki.1008-2344.2022.02.015.
[7]刘勇,卢丹.肿瘤坏死因子Ⅰ型受体及其在细胞增殖和凋亡调节中的作用研究进展[J].临床和实验医学杂志,2018,17(16):1790-1793.
[8]焦俊霞,高维娟.细胞凋亡的信号转导机制研究进展[J].中国老年学杂志,2010,30(06):853-856.
[9]Huang J, Yu S, Ji C, Li J. Structural basis of cell apoptosis and necrosis in TNFR signaling. Apoptosis. 2015 Feb;20(2):210-5. doi: 10.1007/s10495-014-1061-5. PMID: 25451008.
[10]吴晨露,谢南南,周伸奥,孙丽明.程序性细胞坏死的分子机制及其在炎症中的作用[J].中国细胞生物学学报,2016,38(01):7-16.
[11]Wang L, Du F, Wang X. TNF-alpha induces two distinct caspase-8 activation pathways. Cell. 2008 May 16;133(4):693-703. doi: 10.1016/j.cell.2008.03.036. PMID: 18485876.
[12]杨祖阁,王若欣,任昊喆,何峰,马原军,于世宾.程序性坏死在骨骼相关疾病中的研究进展[J].中国骨伤,2021,34(07):687-690.
















































